
Wetenschap
De elektrolyse van Bio Plus produceert Pure Bismuth Hoe lang zou het duren om 10,0 g BI te produceren door de A -oplossing met stroom 25,0 ampère?
1. Bepaal de halfreactie en de constante van Faraday
* halfreactie: De relevante halfreactie is de reductie van bismut (III) ionen:
Bi³⁺ (aq) + 3e⁻ → bi (s)
* Faraday's Constant (F): Deze constante vertegenwoordigt de lading die wordt gedragen door één mol elektronen, ongeveer 96.485 c/mol.
2. Bereken de mol Bismuth
* Molaire massa van Bi: 208,98 g/mol
* mol Bi: (10,0 g bi) / (208,98 g / mol) =0,0478 mol Bi
3. Bereken de vereiste totale lading
* elektronen per mol BI: Vanaf de halve reactie zijn 3 mol elektronen vereist om 1 mol BI te produceren.
* Totale lading (Q): (0,0478 mol Bi) * (3 mol E⁻/mol Bi) * (96.485 C/mol E⁻) =13.850 C
4. Bereken de tijd
* stroom (i): 25.0 A (versterkers)
* tijd (t): Q / i =(13.850 c) / (25,0 a) =554 seconden
5. Converteren naar minuten (optioneel)
* tijd (t): (554 seconden) / (60 seconden / minuut) =9,23 minuten
Daarom zou het ongeveer 9,23 minuten duren om 10,0 g bismut te produceren met behulp van een stroom van 25,0 ampère.
 Wat zijn niet -hernieuwbare middelen in het naaldbos?
Wat zijn niet -hernieuwbare middelen in het naaldbos?  Biotische componenten van ecosystemen
Biotische componenten van ecosystemen Wat als de dinosaurussen niet waren uitgestorven? Waarom onze wereld er heel anders uit zou kunnen zien
Wat als de dinosaurussen niet waren uitgestorven? Waarom onze wereld er heel anders uit zou kunnen zien  Klimaatverandering brengt gezondheidszorg in gevaar, meldt rapport
Klimaatverandering brengt gezondheidszorg in gevaar, meldt rapport Vijf verschillende soorten abiotische factoren
Vijf verschillende soorten abiotische factoren
Hoofdlijnen
- Wat drinken eencellige organismen?
- We weten nu hoe insecten en bacteriën ijs beheersen
- Onderzoekers beschrijven hoe cellen het afval buiten zetten om ziekten te voorkomen
- Wat betekent het woord beschrijven in de wetenschap?
- Onderzoekers ontdekken hoe mitochondriën om hulp vragen als ze onder stress staan
- Onderzoekers gezocht:mensen hoeven niet te solliciteren?
- Hoe wordt een schaaldier een krab?
- Wetenschappers en boeren werken samen om Afrikaans liefdegras uit te roeien
- Diep in het vliegenbrein, een aanwijzing voor hoe evolutie de geest verandert
- Kunstmatige antimicrobiële peptiden kunnen helpen om resistente bacteriën te overwinnen
- Duurzame scheidingstechnologie maakt nieuwe toepassingen mogelijk

- Zwarte fosfor belooft de toekomst van elektronica

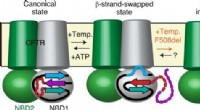
- Uiterlijk van cystische fibrose op moleculaire schaal
- Effectief materiaal ontwikkeld om postoperatieve hechting te voorkomen

 Wat is Jupiter afstand van de zon?
Wat is Jupiter afstand van de zon?  Wat hangt af van de elektrische kracht tussen twee objecten?
Wat hangt af van de elektrische kracht tussen twee objecten?  Bevoorrading van ruimtestation gelanceerd, 2e verzending in 2 dagen
Bevoorrading van ruimtestation gelanceerd, 2e verzending in 2 dagen Leveringen met drones versus vrachtwagens:welke zorgen voor minder CO2-vervuiling?
Leveringen met drones versus vrachtwagens:welke zorgen voor minder CO2-vervuiling?  Hoe veranderen sedimenten in rots?
Hoe veranderen sedimenten in rots?  Afbraak van biobased plastics in de bodem:microbiële gemeenschap trotseert klimaatverandering
Afbraak van biobased plastics in de bodem:microbiële gemeenschap trotseert klimaatverandering EPA volgt de historische wet niet om kinderen te beschermen tegen pesticiden in voedsel
EPA volgt de historische wet niet om kinderen te beschermen tegen pesticiden in voedsel Kunt u het verschil uitleggen tussen een maan- en een zonsverduistering en hoe ze verschillen in termen van zichtbaarheidsimpact op aarde?
Kunt u het verschil uitleggen tussen een maan- en een zonsverduistering en hoe ze verschillen in termen van zichtbaarheidsimpact op aarde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

