
Wetenschap
Een alcoholische jodiumoplossing wordt bereid door 4,65 g kristallen op te lossen in voldoende alcohol om een volume 235 ml te maken die de molariteitsoplossing berekenen?
Hier leest u hoe u de molariteit van de alcoholische jodiumoplossing kunt berekenen:
1. Bepaal het molecuulgewicht van jodium (i₂)
* Het atoomgewicht van jodium is 126,90 g/mol.
* Aangezien jodium bestaat als een diatomisch molecuul (I₂), is het molecuulgewicht 2 * 126,90 g/mol =253,80 g/mol.
2. Bereken de mol jodium
* Verdeel de massa jodium door zijn molecuulgewicht:
* Mol I₂ =4,65 g / 253.80 g / mol =0,0183 mol
3. Converteer volume naar liters
* 235 ml =0,235 l
4. Molariteit berekenen
* Molariteit (m) =mol opgeloste stof / volume van oplossing in liters
* M =0,0183 mol / 0,235 l =0,0779 m
Daarom is de molariteit van de alcoholische jodiumoplossing ongeveer 0,0779 m.
 Ja, het is heel goed mogelijk voor Australië om thermische steenkool binnen tien jaar uit te faseren
Ja, het is heel goed mogelijk voor Australië om thermische steenkool binnen tien jaar uit te faseren Waarom je nu moet deelnemen aan het geo-engineeringdebat
Waarom je nu moet deelnemen aan het geo-engineeringdebat Als asboorder vaten door Noord-Amerikaanse bossen, wetenschappers en stammen werken samen om een standpunt in te nemen
Als asboorder vaten door Noord-Amerikaanse bossen, wetenschappers en stammen werken samen om een standpunt in te nemen Historisch klimaat belangrijk voor bodemreacties op toekomstige klimaatverandering
Historisch klimaat belangrijk voor bodemreacties op toekomstige klimaatverandering Leider van de Marshalleilanden roept op om hulp bij klimaatverandering
Leider van de Marshalleilanden roept op om hulp bij klimaatverandering
Hoofdlijnen
- Wat zijn eerstelijns verdedigingen tegen pathogenen in het algemeen?
- Onderzoek toont aan hoe het eiwit de ontwikkeling van fruitvliegvleugels regelt
- Waarom gebruikten biologen classificatie?
- Kunnen we het evolutionaire concept van mensen toepassen?
- Wat zijn de 5Kingdoms die u gebruikt om organismen te classificeren?
- Wat is dat fossiel? Een app heeft antwoorden
- Stealth privatisering in iconische nationale parken bedreigt publieke toegang tot natuurlijke gezondheidsboost
- Wat is een systeem van membranen en buizen die het nucleaire membraanplasma verbinden?
- Wat gebeurt er als een B -cel een antigeen herkent?
- Biosensortechnologieën om effectievere benaderingen van ziektebehandeling te bieden

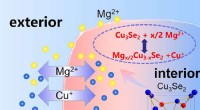
- Koperion ontsluit magnesiumpotentieel in batterijen van de volgende generatie
- Nieuwe tool monitort realtime mutaties bij griep
- Boomschors en compost omzetten in vliegtuigvleugels en plastic zakken

- Hydrodynamica in celstudies
 Zwitsers zakmeskatalysator kan aardgas schoner maken
Zwitsers zakmeskatalysator kan aardgas schoner maken Afbeelding:Noordpool van Enceladus
Afbeelding:Noordpool van Enceladus Hittetolerante broccoli voor de toekomst
Hittetolerante broccoli voor de toekomst Wat onthult een Dark Line Spectrum van een sterren?
Wat onthult een Dark Line Spectrum van een sterren?  Wat zijn drie banen die betrekking hebben op de wetenschap?
Wat zijn drie banen die betrekking hebben op de wetenschap?  Typen vervuiling gevonden in Brownfields
Typen vervuiling gevonden in Brownfields Wanneer golven van snelheid veranderen als ze van het ene medium naar het andere passeren?
Wanneer golven van snelheid veranderen als ze van het ene medium naar het andere passeren?  Spotify wint meer fans bij beursdebuut nu aandelen stijgen
Spotify wint meer fans bij beursdebuut nu aandelen stijgen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

