
Wetenschap
Wat maakt deze als deze CO2 en H2O mixen?
1. Fysiek mixen:
* opgelost CO2 in water: CO2 is enigszins oplosbaar in water en vormt een oplossing. Dit is de meest voorkomende interactie bij kamertemperatuur en druk. De opgeloste CO2 kan het water enigszins zuur maken.
* Vorming van koolzuur (H2CO3): In water reageert een klein deel opgeloste CO2 met watermoleculen om koolzuur te vormen. Dit is een zwak zuur dat verder kan dissociëren in bicarbonaat (HCO3-) en carbonaat (CO32-) ionen.
* Mengen van gasvormige CO2 en vloeibaar water: Als CO2 door water wordt geborreld of als ze onder druk worden gemengd, zal CO2 oplost in het water, waardoor een oplossing wordt gevormd en de zuurgraad wordt vergroot.
2. Chemische reacties:
* fotosynthese: In aanwezigheid van zonlicht en chlorofyl gebruiken planten CO2 en water om glucose en zuurstof te produceren. Dit is de primaire manier waarop CO2 uit de atmosfeer wordt verwijderd.
* carbonatatie: Wanneer CO2 wordt opgelost onder druk in water, vormt het koolzuur, dat het water een "bruisende" of "sprankelende" kwaliteit geeft, zoals te zien in koolzuurhoudende dranken.
* Vorming van carbonaten en bicarbonaten: Carbonzuur reageert met mineralen zoals calciumcarbonaat (CACO3) om bicarbonaten te vormen (bijv. Calciumbicarbonaat, CA (HCO3) 2). Dit proces is belangrijk bij de vorming van grotten en Karst -landschappen.
omstandigheden die de interactie beïnvloeden:
* Druk: Hogere druk verhoogt de oplosbaarheid van CO2 in water.
* Temperatuur: Hogere temperatuur verlaagt de oplosbaarheid van CO2 in water.
* pH: De pH van de oplossing beïnvloedt het evenwicht tussen opgeloste CO2, koolzuur, bicarbonaat en carbonaationen.
Samenvattend kan de interactie tussen CO2 en H2O een eenvoudige fysieke menging of een meer complexe chemische reactie zijn, afhankelijk van de specifieke omstandigheden. Deze interacties spelen een cruciale rol in verschillende natuurlijke processen en hebben belangrijke implicaties voor het milieu en het klimaat.
 Aanpak maakt weg vrij voor nieuwe generatie antimicrobiële materialen
Aanpak maakt weg vrij voor nieuwe generatie antimicrobiële materialen Is een koolhydraat anorganisch of organisch?
Is een koolhydraat anorganisch of organisch?  Waarom worden legeringen gebruikt in plaats van pure metalen?
Waarom worden legeringen gebruikt in plaats van pure metalen?  Welke kleur draait ijzer (III) chloride in de vlamtest?
Welke kleur draait ijzer (III) chloride in de vlamtest?  Onderzoekers beoordelen de vooruitgang in 3D-printen van legeringen met hoge entropie
Onderzoekers beoordelen de vooruitgang in 3D-printen van legeringen met hoge entropie
 Moedig rijken en goed verbonden aan om hun invloed te gebruiken om klimaatverandering aan te pakken:studie
Moedig rijken en goed verbonden aan om hun invloed te gebruiken om klimaatverandering aan te pakken:studie Wat moet er worden opgenomen in een wetenschappelijk project?
Wat moet er worden opgenomen in een wetenschappelijk project?  Onderzoek onthult snel Antarctisch ijsverlies als gevolg van opwarming van de oceaan
Onderzoek onthult snel Antarctisch ijsverlies als gevolg van opwarming van de oceaan Expeditie naar Peru legt klimaatgeschiedenis vast in ijs - voordat het weg is
Expeditie naar Peru legt klimaatgeschiedenis vast in ijs - voordat het weg is een dode, toeristen gestrand bij uitbarsting vulkaan Nieuw-Zeeland
een dode, toeristen gestrand bij uitbarsting vulkaan Nieuw-Zeeland
Hoofdlijnen
- Wat is de chemische basis van Gene -afdruk?
- Welke methode gebruiken wetenschappers om identieke nakomelingen te maken uit volwassen cellen?
- Een vroeg kerstcadeau:wetenschappers hebben het rendiergenoom uitgepakt
- Typen biologie-experimenten
- Processen die ATP
- Hoe je je hond traint in basisvaardigheden en waarom het belangrijk is
- Met welke bio -molecuul in mitochondria kan het zich onafhankelijk van de cel reproduceren?
- Welke deeltjes bevinden zich in de kern?
- Veel functies van het plasmamembraan worden uitgevoerd door?
- Goedkope detector is als klittenband voor kankercellen
- Nieuwe RNA-modificerende tool corrigeert genetische ziekten, inclusief aanjager van triple-negatieve borstkanker

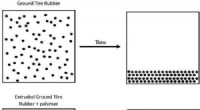
- Polymeren effenen de weg voor een breder gebruik van gerecyclede banden in asfalt
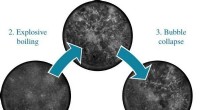
- Roodgloeiend staal koelen met warm water
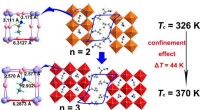
- Onderzoekers verwerven gelaagde metaalhalogenide-ferro-elektriciteit met hoge Curie-temperatuur via kooi-begrensde ethylaminerotators
 Tropische vissen... in het noorden? Hoe oceaanfysica de watertemperatuur en het zoutgehalte verandert
Tropische vissen... in het noorden? Hoe oceaanfysica de watertemperatuur en het zoutgehalte verandert Welk mineraal is zeer reactief en wordt gebruikt als bron van atoomenergie voor het bommen van kerncentrales?
Welk mineraal is zeer reactief en wordt gebruikt als bron van atoomenergie voor het bommen van kerncentrales?  Hoe zijn zowel cel- als celmembraan?
Hoe zijn zowel cel- als celmembraan?  Het opzetten van een buiten-tv of -projector is eenvoudiger geworden
Het opzetten van een buiten-tv of -projector is eenvoudiger geworden Wat als de VS al hun afval op één gigantische stortplaats zouden gooien?
Wat als de VS al hun afval op één gigantische stortplaats zouden gooien?  Soorten wolken voor kinderen
Soorten wolken voor kinderen Hoe een absolute-waardevennoot of -ongelijkheid op een getallenlijn te zetten
Hoe een absolute-waardevennoot of -ongelijkheid op een getallenlijn te zetten  Wat is een energiebron geproduceerd uit atoomreacties zoals olie?
Wat is een energiebron geproduceerd uit atoomreacties zoals olie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

