
Wetenschap
In het samengestelde natriumfluoride verliest NAF -atoom één elektron- en fluorwinst om ionen te vormen met elektronenconfiguraties die vergelijkbaar zijn met?
* natrium (NA): Natrium heeft een atoomnummer van 11, wat betekent dat het 11 elektronen heeft. De elektronenconfiguratie is 1S² 2S² 2P⁶ 3S¹. Wanneer natrium één elektron verliest, wordt het een positief geladen ion (Na⁺) met de elektronenconfiguratie 1S² 2S² 2P⁶ , die hetzelfde is als het edelgas neon (ne) .
* fluor (f): Fluor heeft een atoomnummer van 9, wat betekent dat het 9 elektronen heeft. De elektronenconfiguratie is 1S² 2S² 2P⁵. Wanneer fluor één elektron wint, wordt het een negatief geladen ion (F⁻) met de elektronenconfiguratie 1S² 2S² 2P⁶ , die ook hetzelfde is als het edelgas neon (ne) .
Samenvattend:
Door een elektron te verliezen, bereikt natrium een stabiele elektronenconfiguratie zoals Neon. Door een elektron te krijgen, bereikt fluor ook een stabiele elektronenconfiguratie zoals neon. Deze neiging om elektronen te winnen of te verliezen om een stabiele adellijke gasconfiguratie te bereiken is een belangrijk principe bij ionische binding.
 Welke geografische systemen creëren mensen op aarde?
Welke geografische systemen creëren mensen op aarde?  Koelere, nattere delen van de Pacific Northwest zullen waarschijnlijk meer branden zien, voorspellen nieuwe simulaties
Koelere, nattere delen van de Pacific Northwest zullen waarschijnlijk meer branden zien, voorspellen nieuwe simulaties  Wetenschappers vinden ijzersneeuw in de kern van de aarde
Wetenschappers vinden ijzersneeuw in de kern van de aarde Mexico's weg naar herstel na aardbevingen is veel langer dan het lijkt
Mexico's weg naar herstel na aardbevingen is veel langer dan het lijkt Nieuw-Zeelandse bedrijven lopen achter op anderen in hun rapportage over klimaatverandering, en dat is een risico voor hun reputatie
Nieuw-Zeelandse bedrijven lopen achter op anderen in hun rapportage over klimaatverandering, en dat is een risico voor hun reputatie
Hoofdlijnen
- Zenuwen controleren de bacteriële gemeenschap van het lichaam
- Wat is de functie van complexe koolhydraten?
- Welke term definieert een proces waarmee gunstige eigenschappen van een organisme vaker voorkomen in opeenvolgende generaties en ongunstig minder gebruikelijk?
- Waarom je moet letten op vliegend braaksel
- Hoeveel ziekten veroorzaakt door platwormen?
- Uit robotsondes blijkt dat de schoonmaak van de Japanse reactor slechter is dan verwacht
- Wetenschappers volgen aseksuele kleine wormen - waarvan de afstamming 18 miljoen jaar teruggaat
- Vogelgezang en menselijke stem opgebouwd uit dezelfde genetische blauwdruk
- Nieuw hondenvoer? Onderzoek toont aan dat de darmbacteriën van uw hond binnen een week kunnen veranderen
- Sleutelenzym dat in planten wordt aangetroffen, kan de ontwikkeling van medicijnen en andere producten leiden
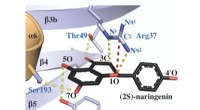
- Een veelbelovende oplossing om de hydrofobiciteit van het oppervlak van hydrofobe membranen te verbeteren
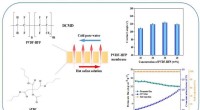
- Van oude mineralen tot nieuwe materialen:voorspelling van smelttemperatuur met behulp van een grafisch neuraal netwerkmodel

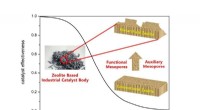
- Rationeel ontwerpen van hiërarchische zeolieten voor betere diffusie en katalysatorefficiëntie
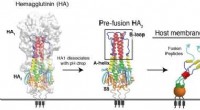
- Onderzoekers vinden nieuwe manier om griepvirus aan te pakken
 De hoeveelheid licht die door 1 elektron wordt uitgezonden, daalt van het 7e naar het 2e energieniveau?
De hoeveelheid licht die door 1 elektron wordt uitgezonden, daalt van het 7e naar het 2e energieniveau?  Lessen over klimaatverandering van koraalriffen in de Arabische Golf
Lessen over klimaatverandering van koraalriffen in de Arabische Golf Zorgt de recycling van ATP voor voortzetting glycolyse onder anaërobe omstandigheden?
Zorgt de recycling van ATP voor voortzetting glycolyse onder anaërobe omstandigheden?  Hoe creëren producenten hun eigen voedsel?
Hoe creëren producenten hun eigen voedsel?  Zal het duwen van een auto altijd de mechanische energie van de auto's veranderen Wat moet er gebeuren om kinetisch te verhogen?
Zal het duwen van een auto altijd de mechanische energie van de auto's veranderen Wat moet er gebeuren om kinetisch te verhogen?  Is er leven op drift in de wolken van Venus?
Is er leven op drift in de wolken van Venus?  Klokken die vooruitgaan kunnen beleggers doen dutten:hoe de reacties van beleggers worden beïnvloed door slaapverstoring
Klokken die vooruitgaan kunnen beleggers doen dutten:hoe de reacties van beleggers worden beïnvloed door slaapverstoring  Nieuwe kanker-nanogeneeskunde vermindert de groei van pancreastumoren
Nieuwe kanker-nanogeneeskunde vermindert de groei van pancreastumoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

