
Wetenschap
Wat doet Anion als je over het periodieke tabel gaat?
* elektronegativiteit: Elektronegativiteit, het vermogen van een atoom om elektronen aan te trekken, neemt toe naarmate je over een periode beweegt. Dit komt omdat het aantal protonen in de kern toeneemt, wat leidt tot een sterkere aantrekkingskracht voor elektronen.
* Effectieve nucleaire lading: De effectieve nucleaire lading, de netto positieve lading die wordt ervaren door valentie -elektronen, neemt ook toe naarmate u over een periode beweegt. Dit komt door het toenemende aantal protonen en het afschermingseffect van binnenste elektronen die relatief constant blijven.
* Elektronenaffiniteit: Elektronenaffiniteit, de verandering in energie wanneer een elektron wordt toegevoegd aan een neutraal atoom, heeft ook de neiging om gedurende een periode toe te nemen.
Deze factoren betekenen dat atomen aan de rechterkant van de periodiek systeem (niet -metalen) een hogere neiging hebben om elektronen te krijgen en anionen te vormen.
Voorbeeld:
* natrium (NA): Natrium heeft een lage elektronegativiteit en verliest gemakkelijk zijn valentie -elektron om een +1 kation te vormen (Na +).
* chloor (CL): Chloor heeft een hoge elektronegativiteit en krijgt gemakkelijk een elektron om een -1 anion te vormen (Cl-).
Uitzonderingen:
Hoewel de algemene trend voor anionische lading is om gedurende een periode te stijgen, zijn er uitzonderingen. Sommige elementen, zoals edelgassen, zijn bijvoorbeeld zeer stabiel en vormen geen gemakkelijk anionen.
Opmerking:
De term "anion" verwijst naar een negatief geladen ion, ongeacht de aanklacht. De specifieke lading van een anion hangt af van het element en het aantal elektronen dat het wint.
 Peuterskelet geeft aan dat neanderthalers hun doden hebben begraven
Peuterskelet geeft aan dat neanderthalers hun doden hebben begraven  Wat voor soort weer komt voor langs een stilstaand front?
Wat voor soort weer komt voor langs een stilstaand front?  Rook van bosbranden kan leiden tot minder regen in het westen van de VS
Rook van bosbranden kan leiden tot minder regen in het westen van de VS De IPCC's State of the Climate Report komt eraan,
De IPCC's State of the Climate Report komt eraan,  Jelawat niet gezien als een bedreiging voor de Filipijnen
Jelawat niet gezien als een bedreiging voor de Filipijnen
Hoofdlijnen
- Nieuwe bevindingen suggereren hoe en waarom temperaturen het geslacht van schildpadden bepalen
- Een 'zenuwstelsel' voor mierenkolonies? Kolonie reageert op predatiesimulatie als een 'superorganisme'
- Onderzoek laat zien hoe beschadigde celkernen zichzelf opnieuw afsluiten en repareren
- Dieetgeheimen van 'the Royals' - Isotopen van haar van olifantenstaarten laten zien dat vee de dikhuiden verslindt
- Hoe witrot vers gesneden voedsel aanpakt
- Wat is een voorbeeld van kern?
- Aangeboren gedrag bepaalt hoe we onze auto besturen
- Veranderingen in het bladerdak vergemakkelijkten de evolutie van het allereerste glijdende reptiel, suggereert nieuw onderzoek
- Komt celafval voort uit activiteiten?
- Een nieuwe katalysator voor watersplitsing die het beste van twee werelden is
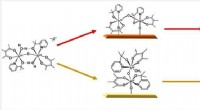
- Twee-in-één contrastmiddel voor medische beeldvorming
- Nieuwe technologie voltooit vitale klasse van industriële reacties vijf keer sneller

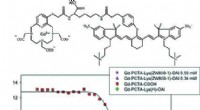
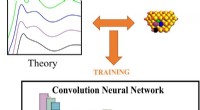
- Machine learning-analyse van röntgengegevens selecteert belangrijke katalytische eigenschappen
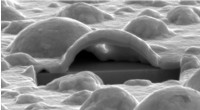
- Platina vormt nanobellen
 Waar groeien Gardenias in de VS?
Waar groeien Gardenias in de VS?  Onderzoekers vinden bewijs van een kosmische impact die de vernietiging van een van 's werelds vroegste menselijke nederzettingen heeft veroorzaakt
Onderzoekers vinden bewijs van een kosmische impact die de vernietiging van een van 's werelds vroegste menselijke nederzettingen heeft veroorzaakt Tienergamers hebben evenveel vrienden als niet-gamers
Tienergamers hebben evenveel vrienden als niet-gamers Kleine koolstofnanobuisjes vertonen een groot kiembestrijdend potentieel
Kleine koolstofnanobuisjes vertonen een groot kiembestrijdend potentieel  Diepe evolutionaire verbanden tussen monogamie en vaderschap zijn ingewikkelder dan we dachten
Diepe evolutionaire verbanden tussen monogamie en vaderschap zijn ingewikkelder dan we dachten Afstotend onderzoek:marine ontwikkelt scheepscoatings om brandstof te verminderen, energiekosten
Afstotend onderzoek:marine ontwikkelt scheepscoatings om brandstof te verminderen, energiekosten Wiskundig raamwerk verandert elk vel materiaal in elke vorm met behulp van kirigami-sneden
Wiskundig raamwerk verandert elk vel materiaal in elke vorm met behulp van kirigami-sneden Oproep om een welzijnsindex toe te voegen aan nationale economische maatregelen
Oproep om een welzijnsindex toe te voegen aan nationale economische maatregelen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

