
Wetenschap
Wat is het Bohr -model voor lithium?
1. Inzicht in de basis
* Atomisch nummer: Lithium heeft een atoomnummer van 3, wat betekent dat het 3 protonen en 3 elektronen heeft.
* Elektronenconfiguratie: Het BOHR -model rangschikt elektronen in specifieke energieniveaus of schalen. Lithium's elektronenconfiguratie is 2,1. Dit betekent:
* shell 1 (k shell): Bevat 2 elektronen
* shell 2 (l shell): Bevat 1 elektron
2. Het Bohr -modeldiagram
* Nucleus: Teken een cirkel die de kern vertegenwoordigt. Label het met "3 protonen" en "4 neutronen" (de meest voorkomende isotoop van Lithium heeft 4 neutronen).
* elektronenschalen: Teken concentrische cirkels rond de kern om de elektronenschalen weer te geven.
* elektronen: Plaats de elektronen in hun respectieve schelpen.
* shell 1: 2 elektronen
* shell 2: 1 elektron
3. Belangrijkste punten
* energieniveaus: Het BOHR -model gaat ervan uit dat elektronen alleen in specifieke energieniveaus kunnen bestaan.
* cirkelvormige banen: Het toont elektronen die rond de kern draaien in cirkelvormige paden. Dit is een vereenvoudigde weergave; Elektronen bewegen eigenlijk meer complexe, driedimensionale patronen.
* Quantumsprongen: Elektronen kunnen tussen energieniveaus springen door energie te absorberen of uit te stoten.
* Beperkingen: Het BOHR-model is een vereenvoudigde weergave en houdt niet volledig rekening met de golfdeeltjesdualiteit van elektronen of de complexe interacties in atomen.
Bohr -modeldiagram voor lithium:
`` `
(L Shell) - 1 elektron
/ \
/ \
/ \
(K shell) - 2 elektronen
/ \
/ \
/ \
--------
3 protonen
4 neutronen
`` `
Belangrijke opmerking: Het BOHR -model is een nuttig hulpmiddel voor het visualiseren van de basisstructuur van atomen, maar het biedt geen compleet of volledig nauwkeurig beeld van atomair gedrag.
 Crowded Plate-technieken in Microbiology
Crowded Plate-technieken in Microbiology Hoe kanonskogels werken
Hoe kanonskogels werken  Studie van zirkoonkristallen doet twijfel rijzen over bewijs voor vroege ontwikkeling van magnetisch veld
Studie van zirkoonkristallen doet twijfel rijzen over bewijs voor vroege ontwikkeling van magnetisch veld Tropisch fruit is kwetsbaar voor klimaatverandering. Kunnen we ze op tijd veerkrachtig maken?
Tropisch fruit is kwetsbaar voor klimaatverandering. Kunnen we ze op tijd veerkrachtig maken?  Stewardshipbeleid vermindert het gebruik van antibiotica op boerderijen
Stewardshipbeleid vermindert het gebruik van antibiotica op boerderijen
Hoofdlijnen
- Cellenkenmerken gevonden in plantencel en de functie ervan?
- Wat is het belangrijkste wetenschapsgebied?
- Wat wordt er van verschillende typen weefsels gemaakt?
- Welke wetenschapswoorden beginnen met de letter y?
- Coyotes zijn hier om te verblijven in Noord-Amerikaanse steden. Hoe je ze van een afstand kunt waarderen
- Waarom is water belangrijk voor levende organismen?
- Hoe bacteriën zwemmen:onderzoekers ontdekken nieuwe mechanismen
- Hoe ribosomen in onze cellen eiwitvouwing mogelijk maken
- Selenium beschermt specifieke interneuronen in de hersenen
- Wetenschappers ontwikkelen betere manier om virussen te blokkeren die luchtweginfecties bij kinderen veroorzaken
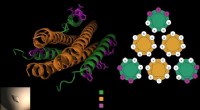
- Chemici ontwikkelen hydrogelsnaren met behulp van verbindingen die in zeedieren worden gevonden
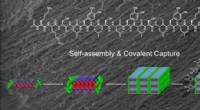
- Nieuw molecuul zet de toon voor nikkel als groenere fotokatalysator, onthult belangrijke stappen in reactieproces
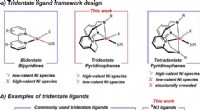
- Een beter microgrid printen

- Wetenschappers maken biologisch afbreekbare microbeads van cellulose
 Is sinaasappelsap alkali zuur of neutraal?
Is sinaasappelsap alkali zuur of neutraal?  Het produceren van foutloze metaalkristallen van ongekende grootte
Het produceren van foutloze metaalkristallen van ongekende grootte Een ohmmeter gebruiken om een AC-transformator te testen
Een ohmmeter gebruiken om een AC-transformator te testen Wat gebeurt er als twee verschillende soorten proberen dezelfde niche te bezetten?
Wat gebeurt er als twee verschillende soorten proberen dezelfde niche te bezetten?  Virus brengt toekomst luchtvaart in gevaar zonder staatssteun:Lufthansa
Virus brengt toekomst luchtvaart in gevaar zonder staatssteun:Lufthansa Het cadmiumgehalte in cacao verlagen
Het cadmiumgehalte in cacao verlagen Simulaties verklaren gigantische exoplaneten met excentrische, dichte banen
Simulaties verklaren gigantische exoplaneten met excentrische, dichte banen Wat is het belangrijkste idee van overproductie bij natuurlijke selectie?
Wat is het belangrijkste idee van overproductie bij natuurlijke selectie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

