Wetenschap
Waarom reageert magnesiummetaal sneller met zoutzuur dan ijzer?
1. Reactiviteitsreeks:
* Magnesium is hoger in de reactiviteitsreeks dan ijzer. Dit betekent dat magnesiumatomen gemakkelijker worden geoxideerd (elektronen verliezen) dan ijzeratomen.
2. Elektrodepotentiaal:
* Magnesium heeft een meer negatieve standaardelektrodepotentiaal dan ijzer. Dit geeft aan dat magnesium een sterkere neiging heeft om elektronen te verliezen en geoxideerd te worden in vergelijking met ijzer.
3. Standaardreductiepotentieel:
* Het standaardreductiepotentieel van magnesium is -2,37 V, terwijl dat van ijzer -0,44 V. Dit verschil in reductiepotentieel benadrukt verder de hogere neiging van magnesium om elektronen te verliezen.
4. Activeringsenergie:
* De activeringsenergie voor de reactie tussen magnesium en zoutzuur is lager dan die voor de reactie tussen ijzer en zoutzuur. Dit betekent dat de reactie tussen magnesium en zoutzuur minder energie vereist om te beginnen en door te gaan.
5. Oppervlakte:
* Magnesium heeft typisch een groter oppervlak dan ijzer, dat het contactoppervlak tussen het metaal en het zuur verhoogt, wat leidt tot een snellere reactiesnelheid.
Reactievergelijkingen:
* magnesium: Mg (s) + 2HCl (aq) → mgcl₂ (aq) + h₂ (g)
* ijzer: Fe (s) + 2HCl (aq) → fecl₂ (aq) + h₂ (g)
Samenvattend wordt de snellere reactiesnelheid van magnesium met zoutzuur toegeschreven aan zijn hogere reactiviteit, meer negatieve elektrodepotentiaal, lagere activeringsenergie en mogelijk groter oppervlak in vergelijking met ijzer.
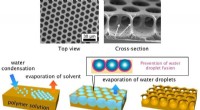
 Uiterst nauwkeurige besturing van gedrukte elektronica
Uiterst nauwkeurige besturing van gedrukte elektronica Wat wordt gevormd met ethanol en kaneelzuur?
Wat wordt gevormd met ethanol en kaneelzuur?  Wat is de gebalanceerde vergelijking van stikstofmonoxide met zuurstof om dioxyde te produceren bij een evenwichtsconstante?
Wat is de gebalanceerde vergelijking van stikstofmonoxide met zuurstof om dioxyde te produceren bij een evenwichtsconstante?  Defecte koolstof vereenvoudigt de productie van waterstofperoxide
Defecte koolstof vereenvoudigt de productie van waterstofperoxide Wat is de opgeloste stof in tafelzout?
Wat is de opgeloste stof in tafelzout?
 De tak van de wetenschap die zich bezighoudt met wetenschappelijke studiebodem?
De tak van de wetenschap die zich bezighoudt met wetenschappelijke studiebodem?  Hoe verschilt een tropisch droog klimaat van het natte klimaat?
Hoe verschilt een tropisch droog klimaat van het natte klimaat?  Wat is de betekenis van tropisch klimaat?
Wat is de betekenis van tropisch klimaat?  Studie onderzoekt de ecologische voetafdruk van Californische melkkoeien over een periode van 50 jaar
Studie onderzoekt de ecologische voetafdruk van Californische melkkoeien over een periode van 50 jaar Bemanningen vechten tegen laatste hardnekkige bosbrand in Zuid-Californië
Bemanningen vechten tegen laatste hardnekkige bosbrand in Zuid-Californië
Hoofdlijnen
- Zou een wetenschapper in deze populatie van organismen hoogstwaarschijnlijk direct bewijs van evolutionaire verandering kunnen waarnemen?
- 3 Eigenschappen van een cel
- Gekruiste (evolutionaire) signalen?
- De methoden van inventarisatie in Microbes
- Wat betekent investering in de wetenschap?
- Welke eiwitvezel wordt gebruikt voor cellulaire beweging en zijn extreem dun in grootte?
- Welk molecuul is verantwoordelijk voor het dragen van gentic informatie uit de kern van cel in cytoplasma?
- In de ruimte gekweekte vliegen vertonen een verzwakte immuniteit tegen schimmels
- Antidepressiva uit urine maken vissen minder bang voor roofdieren
 Wat is de functie van een spanningsregelaar?
Wat is de functie van een spanningsregelaar?  De verschillende enzymen in uw lichaam worden overwogen welke groep macromoleculen?
De verschillende enzymen in uw lichaam worden overwogen welke groep macromoleculen?  Hoe wordt de kracht uitgeoefend in verspringen om kracht en afstand te creëren?
Hoe wordt de kracht uitgeoefend in verspringen om kracht en afstand te creëren?  Waarom reflecteren oppervlakken licht?
Waarom reflecteren oppervlakken licht?  Welke revolutie van de buitenste planeten is 17 graden op de elliptische?
Welke revolutie van de buitenste planeten is 17 graden op de elliptische?  Stabiele huisvesting in de kinderschoenen levert levenslange uitkeringen op
Stabiele huisvesting in de kinderschoenen levert levenslange uitkeringen op Hoe is een baan rond de zon vergelijkbaar met banen van andere planetenzon?
Hoe is een baan rond de zon vergelijkbaar met banen van andere planetenzon?  Wat bestaat uit slechts één atoom en heeft een chemisch symbool dat niet kan worden verdeeld in eenvoudiger stoffen?
Wat bestaat uit slechts één atoom en heeft een chemisch symbool dat niet kan worden verdeeld in eenvoudiger stoffen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com