
Wetenschap
Wat is de valentie van koolstof?
Dit is waarom:
* Elektronische configuratie: Koolstof heeft een atoomnummer van 6, wat betekent dat het 6 elektronen heeft. De elektronische configuratie is 2, 4. Dit betekent dat het 4 elektronen heeft in zijn buitenste schaal (valentieschaal).
* neiging om te binden: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiel octet (8 elektronen) in hun buitenste schaal te bereiken. Koolstof heeft 4 meer elektronen nodig om deze stabiliteit te bereiken.
* bindingscapaciteit: Koolstof kan 4 covalente bindingen vormen met andere atomen om zijn 4 valentie -elektronen te delen. Dit geeft het een valentie van 4.
Dit is de reden waarom koolstof de ruggengraat vormt van zoveel organische moleculen, waardoor verschillende en complexe structuren ontstaan!
 Natuurkundigen leggen uit waarom veranderingen in het magnetische veld van de aarde zwakker zijn boven de Stille Oceaan
Natuurkundigen leggen uit waarom veranderingen in het magnetische veld van de aarde zwakker zijn boven de Stille Oceaan Hoe EnviroGrid werkt
Hoe EnviroGrid werkt  Nieuw lavameer laat DR Congo-vulkaan ademen, deskundigen zeggen
Nieuw lavameer laat DR Congo-vulkaan ademen, deskundigen zeggen Verwaarloosde soorten:wie maakt zich druk over de bedreigde tulpen in Kirgizië?
Verwaarloosde soorten:wie maakt zich druk over de bedreigde tulpen in Kirgizië?  Enorme brand verwoest het grootste natuurreservaat van Polen
Enorme brand verwoest het grootste natuurreservaat van Polen
Hoofdlijnen
- Oude beenviskrachten heroverwegen hoe haaien evolueerden
- Hoe verschillen twee dochtercellen?
- Nieuwe kandidaat-genen voor menselijke mannelijke onvruchtbaarheid gevonden door het ongebruikelijke voortplantingssysteem van gorilla's te analyseren
- Herstel van de Braziliaanse Spixs-ara, gepopulariseerd in geanimeerde Rio-films, bedreigd door klimaatverandering
- Hoe planten een gevaarlijke wereld van ziekteverwekkers afweren
- Welk organisme heeft mitochondriën met schijfvormige cristae?
- Wetenschappers laten zien hoe vrouwelijke gameten het herstel van de bevruchting in bloeiende planten regelen
- Hoe de darmbacteriën van honingbijen helpen bij het verteren van hun stuifmeelrijke voeding
- Ouderleeftijd kan een belangrijke factor zijn om volbloedpaarden als eerste voorbij de post te helpen
- Door poreus materiaal kunnen autonome onderwatervoertuigen verder reizen

- Onderzoekers ontwikkelen snellere test voor cannabiskwaliteit

- Gesprek tussen een bioloog en een filosoof:is de mens een halfgod geworden?

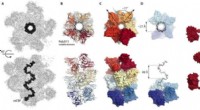
- Wetenschappers maken beelden van antilichamen die samenwerken tegen malaria
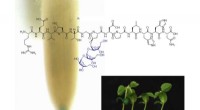
- Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren
 Een neutraal atoom heeft atoomnummer 12 en massa 24. Hoeveel elektronen bevat het?
Een neutraal atoom heeft atoomnummer 12 en massa 24. Hoeveel elektronen bevat het?  Wat is de periode van revolutie rond het centrum van het centrum?
Wat is de periode van revolutie rond het centrum van het centrum?  Waarom beweegt een slang op glad oppervlak?
Waarom beweegt een slang op glad oppervlak?  Welke factoren beïnvloeden het klimaat van de regio Great Plains?
Welke factoren beïnvloeden het klimaat van de regio Great Plains?  De droom van een gasboom in Mozambique wordt bedreigd
De droom van een gasboom in Mozambique wordt bedreigd Wat kan de vroege aarde ons leren over de zoektocht naar leven?
Wat kan de vroege aarde ons leren over de zoektocht naar leven?  COVID-19 is een generale repetitie voor ondernemende benaderingen van klimaatverandering
COVID-19 is een generale repetitie voor ondernemende benaderingen van klimaatverandering Onderzoekers onthullen nieuwe hyperlokale luchtvervuilingskaart
Onderzoekers onthullen nieuwe hyperlokale luchtvervuilingskaart
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

