
Wetenschap
Waarom elementair natriumreacties en chloor zo gemakkelijk?
* natrium (na) Heeft een enkele valentie -elektron, wat betekent dat het slechts één elektron hoeft te verliezen om een stabiele, volledige buitenste schaal te bereiken zoals de edelgassen.
* chloor (Cl) heeft zeven valentie -elektronen en moet één elektron krijgen om een stabiele, volledige buitenste schaal te bereiken.
Hier is hoe de reactie plaatsvindt:
1. Natrium verliest gemakkelijk zijn valentie -elektron , een positief geladen natriumion worden (Na+). Dit komt omdat het minder energie vereist om één elektron te verliezen dan om zeven te winnen.
2. chloor krijgt gemakkelijk een elektron , een negatief geladen chloride-ion worden (Cl-). Dit komt omdat het energetisch gunstig is om zijn buitenste schaal te vullen.
3. De tegengesteld geladen ionen worden sterk aangetrokken tot elkaar Vanwege elektrostatische krachten, die een ionische binding vormen. Deze binding creëert een stabiele verbinding, natriumchloride (NaCl), ook bekend als tafelzout.
Sleutelpunten:
* Lage ionisatie -energie van natrium: Natrium verliest gemakkelijk zijn elektron vanwege zijn lage ionisatie -energie.
* Hoge elektronenaffiniteit van chloor: Chloor krijgt gemakkelijk een elektron vanwege de hoge elektronenaffiniteit.
* Sterke ionische binding: De resulterende ionische binding tussen natrium en chloor is zeer sterk, wat bijdraagt aan de hoge reactiviteit van de reactie.
Deze combinatie van factoren maakt de reactie tussen natrium en chloor zeer exotherme (vrijgevende energie), wat leidt tot een krachtige en vaak explosieve reactie.
 Is aardgas onzichtbaar en geurloos?
Is aardgas onzichtbaar en geurloos?  Wat is een lipidemolecuul dat slechts enkele bindingen heeft tussen zijn koolstofatomen?
Wat is een lipidemolecuul dat slechts enkele bindingen heeft tussen zijn koolstofatomen?  Welk element deelt de meeste kenmerken met fluor?
Welk element deelt de meeste kenmerken met fluor?  Voorspel en leg uit welke van de volgende systemen elektrisch geleiders zijn ASOLID NaCl bmolten kan waterige oplossing NaCl?
Voorspel en leg uit welke van de volgende systemen elektrisch geleiders zijn ASOLID NaCl bmolten kan waterige oplossing NaCl?  Wat zijn de samengestelde namen voor stikstof?
Wat zijn de samengestelde namen voor stikstof?
 Kunnen dieren het weer voorspellen?
Kunnen dieren het weer voorspellen?  Onderzoekers ontwikkelen tool om zwerfvuil op zee te volgen dat de oceaan vervuilt
Onderzoekers ontwikkelen tool om zwerfvuil op zee te volgen dat de oceaan vervuilt Toegewijde CO2-uitstoot brengt internationale klimaatdoelen in gevaar, studie vondsten
Toegewijde CO2-uitstoot brengt internationale klimaatdoelen in gevaar, studie vondsten Zoutvervuiling beheren om drinkwaterbronnen en zoetwaterecosystemen te beschermen
Zoutvervuiling beheren om drinkwaterbronnen en zoetwaterecosystemen te beschermen Hoe vogels weg te houden van de Hummingbird Feeder
Hoe vogels weg te houden van de Hummingbird Feeder
Hoofdlijnen
- Onderzoekers ontdekken hoe een belangrijk medicijn tropische parasieten doodt
- Wat in de wereld zijn cellen?
- Hoe verschillen stamcellen van andere cellen?
- Wanneer nemen cellen hun unieke kenmerken aan?
- Herten geven de voorkeur aan inheemse planten die blijvende schade aan bossen achterlaten
- Hoe bijen leven met bacteriën
- Hyfen die horizontaal groeien langs het oppervlak van een voedselbron worden genoemd?
- De controverse over het menselijk brein Nieuwe cellen maken
- Hoe concurrentie en samenwerking tussen bacteriën antibioticaresistentie vormgeven
- Wetenschappers gebruiken licht om vetzuren om te zetten in alkanen
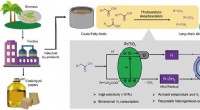
- Replicatie van extract van mangosteenschil als behandeling voor darmontsteking bij mens en dier
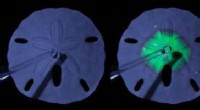
- Van zee-egelskelet tot zonnecel
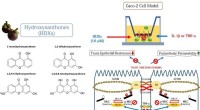
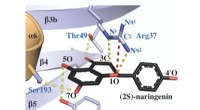
- Sleutelenzym dat in planten wordt aangetroffen, kan de ontwikkeling van medicijnen en andere producten leiden
- Het regent diamanten in het universum, suggereert onderzoek

 Bestrijding van luchtvervuiling in China:waarom secundaire verontreinigende stoffen nu een primaire zorg zijn
Bestrijding van luchtvervuiling in China:waarom secundaire verontreinigende stoffen nu een primaire zorg zijn  Verschil tussen plant- en diercelafdeling
Verschil tussen plant- en diercelafdeling  Wanneer stresshormonen in de bloedbaan worden vrijgegeven, welke van deze fysieke reacties vinden zich voor?
Wanneer stresshormonen in de bloedbaan worden vrijgegeven, welke van deze fysieke reacties vinden zich voor?  Weefselgravende nanodrills richten net genoeg schade aan
Weefselgravende nanodrills richten net genoeg schade aan Kinesins negeren zwakke krachten omdat ze zware lasten dragen
Kinesins negeren zwakke krachten omdat ze zware lasten dragen Sono Motors zet elektrische auto in productiemodus 2019
Sono Motors zet elektrische auto in productiemodus 2019 In welke laag van de aarde vindt convectie plaats?
In welke laag van de aarde vindt convectie plaats?  Is ultraproct hetzelfde als Proctosedyl?
Is ultraproct hetzelfde als Proctosedyl?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

