
Wetenschap
Hoe wordt een molecuul waterstof gevormd uit twee atomen?
1. Elektronenconfiguratie: Elk waterstofatoom heeft één proton en één elektron. Dit enkele elektron bezet zijn 1s orbitaal.
2. Elektronen delen: Wanneer twee waterstofatomen dicht bij elkaar komen, overlappen hun 1s orbitalen. Met deze overlap kunnen de twee elektronen tussen beide atomen worden gedeeld.
3. Covalente bindingsvorming: Dit delen van elektronen creëert een covalente binding , een sterke aantrekkelijke kracht die de twee waterstofatomen bij elkaar houdt als een molecuul. Het gedeelde paar elektronen wordt nu aangetrokken tot beide kernen, waardoor de 1S-orbitalen van beide atomen effectief worden gevuld en een stabiele, lagere energietoestand worden bereikt.
Sleutelpunten:
* stabiliteit: Het waterstofmolecuul (H₂) is stabieler dan twee afzonderlijke waterstofatomen omdat de gedeelde elektronen de 1s orbitalen van beide atomen vullen.
* elektronegativiteit: Beide waterstofatomen hebben dezelfde elektronegativiteit, wat betekent dat ze de gedeelde elektronen gelijk aantrekken. Dit leidt tot een niet -polaire covalente binding , waar de elektronendichtheid gelijkmatig wordt verdeeld.
* Bondlengte: De afstand tussen de twee waterstofkernen in een waterstofmolecuul is ongeveer 74 picometers (0,74 angstroms).
Samenvattend wordt een waterstofmolecuul gevormd door twee waterstofatomen die hun enkele elektronen delen door een covalente binding, waardoor een stabiele, lagere energietoestand ontstaat.
 Hoe geleidbaarheid te berekenen vanwege concentratie
Hoe geleidbaarheid te berekenen vanwege concentratie  Video:Zou je kunnen slagen voor een drugstest door CBD te nemen?
Video:Zou je kunnen slagen voor een drugstest door CBD te nemen? Wat zijn de namenveranderingen en locatie van subatomaire deeltjes?
Wat zijn de namenveranderingen en locatie van subatomaire deeltjes?  Als een vaste stof smelt, verandert deze dan in gas?
Als een vaste stof smelt, verandert deze dan in gas?  25,0 ml van een 0,2450 m NH4CL -oplossing wordt toegevoegd aan 55,5 0,1655 Fecl3 Wat de concentratiechloride -ion in de uiteindelijke oplossing?
25,0 ml van een 0,2450 m NH4CL -oplossing wordt toegevoegd aan 55,5 0,1655 Fecl3 Wat de concentratiechloride -ion in de uiteindelijke oplossing?
 Hoe het water en rioolwater onder je voeten je huis kunnen overstromen (en wat je eraan kunt doen)
Hoe het water en rioolwater onder je voeten je huis kunnen overstromen (en wat je eraan kunt doen) Hoe bomen een storm weerstaan
Hoe bomen een storm weerstaan  Er komen aanwijzingen naar voren in het raadsel van ontbrekende plastic in de oceaan
Er komen aanwijzingen naar voren in het raadsel van ontbrekende plastic in de oceaan Bosbranden verwoesten groot gebied van Oost-Bolivia:NGO
Bosbranden verwoesten groot gebied van Oost-Bolivia:NGO Uit onderzoek blijkt waarom de timing van vogelmigratie verandert
Uit onderzoek blijkt waarom de timing van vogelmigratie verandert
Hoofdlijnen
- Op welke manieren zijn de cellen van planten en dieren verschillend van eencellige eukaryoten?
- Factoren die het succes van translocaties van grizzlyberen beïnvloeden
- Wat is landbouwbiotechnologie? | Hoe dingen werken
- Welke organen zijn bekleed met al het slijmvlies?
- Wat anders tussen relatieve en een absolute celreferentie?
- Wat zijn moleculen die opgeroepen zijn door enzymen die worden genoemd?
- Vrijlating van hagedissen brengt zeldzame soorten terug naar hun natuurlijke habitat in Groot-Brittannië
- Delen van de menselijke hiel
- Wat is de menselijke functie?
- De grenzen van hematiet

- CO2 als grondstof voor kunststoffen en andere producten
- Studie onthult nieuwe bevindingen over synergie van antimicrobiële geneesmiddelen
- Ontdekking van nieuwe organische koperfungiciden met langzame afgifte
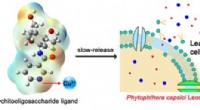
- Magneten gebruiken om chemische reacties te beheersen die gericht zijn op de afgifte van medicijnen in het lichaam

 Maakt het zonnestelsel deel uit van de wereld?
Maakt het zonnestelsel deel uit van de wereld?  Wat doet PSI in gas?
Wat doet PSI in gas?  Zijn de lengtes complete cirkels hoe?
Zijn de lengtes complete cirkels hoe?  Gaspluimen van Kīlauea onthullen verborgen gevaren van vulkanische vervuiling
Gaspluimen van Kīlauea onthullen verborgen gevaren van vulkanische vervuiling Wat is de grotere Pluto of ons?
Wat is de grotere Pluto of ons?  Nieuw-Zeelandse functionaris noemt Facebook moreel failliet
Nieuw-Zeelandse functionaris noemt Facebook moreel failliet Een weergave van lichten boven de storm
Een weergave van lichten boven de storm Hoe wordt lichte energie gebruikt?
Hoe wordt lichte energie gebruikt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

