
Wetenschap
Wat gebeurt er met de natriumchloridekristallen wanneer 10 ml water toegevoegd?
1. Oplossing: De natriumchloridekristallen lossen op in het water. Dit betekent dat de ionische bindingen het natrium (Na+) en chloride (Cl-) ionen in het kristalrooster vasthouden, zijn verbroken.
2. Hydratatie: De watermoleculen omringen de bevrijde Na+ en clies. Het positieve uiteinde van het watermolecuul (waterstof) wordt aangetrokken door de negatief geladen climes en het negatieve uiteinde van het watermolecuul (zuurstof) wordt aangetrokken door de positief geladen Na+ -ionen. Dit proces wordt hydratatie genoemd.
3. Vorming van een waterige oplossing: De gehydrateerde Na+ en clionen worden uniform verspreid over het water en vormen een homogeen mengsel dat een waterige oplossing wordt genoemd.
Wat u waarneemt:
* De kristallen verdwijnen: Je zult merken dat de zoutkristallen geleidelijk verdwijnen als ze oploven.
* Het water wordt zout: De oplossing smaakt zout vanwege de opgeloste natriumchloride -ionen.
Belangrijke opmerking: De hoeveelheid natriumchloride die oplost in 10 ml water wordt beperkt door de oplosbaarheid van natriumchloride. Bij kamertemperatuur kan water ongeveer 36 gram natriumchloride per 100 ml oplossen. Als u meer dan die hoeveelheid toevoegt, zal het overtollige zout niet oplossen en zal zich op de bodem van de container vestigen.
 Voedselovervloed veroorzaakt conflicten in Afrika, geen voedselschaarste
Voedselovervloed veroorzaakt conflicten in Afrika, geen voedselschaarste Wat als er geen zwaartekracht op aarde zou zijn?
Wat als er geen zwaartekracht op aarde zou zijn?  De wortels en de stokken van het zoetwaterbeleid worden onderzocht
De wortels en de stokken van het zoetwaterbeleid worden onderzocht De economische waarde van insectenbestuivingsdiensten is veel hoger dan eerder werd gedacht in de VS
De economische waarde van insectenbestuivingsdiensten is veel hoger dan eerder werd gedacht in de VS Klimaatverandering kan de manier veranderen waarop oceaangolven 50% van 's werelds kustlijnen beïnvloeden
Klimaatverandering kan de manier veranderen waarop oceaangolven 50% van 's werelds kustlijnen beïnvloeden
Hoofdlijnen
- Wat is de Griekse god en is de fysieke beschrijving?
- Wat controleert de biochemische routes van cellen?
- Welke celonderdelen worden alleen aangetroffen in cellen van producenten?
- Café, croissant, wormen? EU-agentschap zegt dat wormen veilig zijn om te eten
- Wat zijn drie moleculen die in de Calvin -cyclus gaan?
- Wat is de naam van uit dierlijke polysachariden samengestelde glucose-eenheden?
- Wat is homeiose?
- Synapsis vormt een chromosoomcomplex dat bekend staat als A?
- Wie concludeerde dat alle planten bestaan uit levende cellen?
- IJzercorroderende bacteriën blijken enzymen te bezitten waardoor ze elektronen uit extracellulaire vaste stoffen kunnen halen
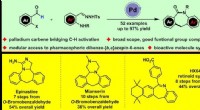
- Modulaire benadering van dibenzo-gefuseerde ε-lactams door middel van carbeen overbruggende CH-activering
- Een nieuwe gerichte evolutietechniek om het potentieel van xeno-nucleïnezuren te ontsluiten
- Een kankervernietigersubstantie met nieuw werkingsmechanisme gevonden

- Hoe elektronen te misleiden om het verborgen gezicht van kristallen te zien

 Is een stollingsgesteente gerelateerd aan graniet?
Is een stollingsgesteente gerelateerd aan graniet?  Is het een versnelling als je een hoek om bycicle omgaat?
Is het een versnelling als je een hoek om bycicle omgaat?  Welke stof wordt uit de atmosfeer verwijderd zodat planten fotosynthese kunnen uitvoeren?
Welke stof wordt uit de atmosfeer verwijderd zodat planten fotosynthese kunnen uitvoeren?  Wat is het verschil tussen viscositeit en vulkanische eruties?
Wat is het verschil tussen viscositeit en vulkanische eruties?  Wat is een leenpaar-elektron?
Wat is een leenpaar-elektron?  Welke golf zorgt ervoor dat deeltjes in materie heen en weer bewegen in dezelfde richting welke golven reizen?
Welke golf zorgt ervoor dat deeltjes in materie heen en weer bewegen in dezelfde richting welke golven reizen?  Wat geeft het symbool 1 na een verbinding aan?
Wat geeft het symbool 1 na een verbinding aan?  Welke golf komt voor wanneer de beweging van het medium rechts engelen (Parpendiclar) is om de golf aan te richten?
Welke golf komt voor wanneer de beweging van het medium rechts engelen (Parpendiclar) is om de golf aan te richten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

