
Wetenschap
Hoeveel mol gas bevinden zich in een kolf bij 95 graden Celsius en 748 Torr als het totale volume 263 ml is?
Hier leest u hoe u dit probleem kunt oplossen met behulp van de ideale gaswet:
1. Converteren eenheden:
* temperatuur (t): 95 graden Celsius tot Kelvin:95 + 273.15 =368.15 K
* druk (p): 748 TORR NAAR Atmosferen:748 Torr / 760 TORR / ATM =0.984 ATM
* volume (v): 263 ml tot liters:263 ml / 1000 ml / l =0,263 l
2. Ideale gaswetvergelijking:
De ideale gaswet is:PV =NRT
* P =druk (atm)
* V =volume (l)
* n =aantal mol
* R =ideale gasconstante (0,0821 l · atm/mol · k)
* T =temperatuur (k)
3. Oplossen voor n (aantal mol):
n =PV / RT
n =(0,984 atm * 0,263 l) / (0,0821 l · atm / mol · k * 368,15 k)
n ≈ 0.0085 Mol
Daarom zijn er ongeveer 0,0085 mol gas in de kolf.
 Een nieuwe perceptueel consistente methode voor visualisatie van massaspectrometriebeeldvorming
Een nieuwe perceptueel consistente methode voor visualisatie van massaspectrometriebeeldvorming Chemici ontwikkelen een nieuwe sensor voor pH-detectie op microvolume
Chemici ontwikkelen een nieuwe sensor voor pH-detectie op microvolume  Wat is het verschil tussen geleiden en niet -bol?
Wat is het verschil tussen geleiden en niet -bol?  Wat is de zoutconcentratie van de oceaan?
Wat is de zoutconcentratie van de oceaan?  Wat zal er hoogstwaarschijnlijk gebeuren met een plant die niet genoeg CO2 ontvangt?
Wat zal er hoogstwaarschijnlijk gebeuren met een plant die niet genoeg CO2 ontvangt?
 Studie van het oude klimaat suggereert dat de toekomstige opwarming zou kunnen versnellen
Studie van het oude klimaat suggereert dat de toekomstige opwarming zou kunnen versnellen Toen Billy door het bos wandelde, vond Billy een plant die hij nog nooit had gezien dat hij het type van wat de veiligste manier was, wilde identificeren, doe dit dan?
Toen Billy door het bos wandelde, vond Billy een plant die hij nog nooit had gezien dat hij het type van wat de veiligste manier was, wilde identificeren, doe dit dan?  Wereldwijde afkoeling na een nucleaire oorlog zou het leven in de oceaan schaden
Wereldwijde afkoeling na een nucleaire oorlog zou het leven in de oceaan schaden Studie werpt licht op waarom een warmere wereld het nattere Noordpoolgebied kan evenaren
Studie werpt licht op waarom een warmere wereld het nattere Noordpoolgebied kan evenaren  Bedreigde planten in het Amazone-regenwoud
Bedreigde planten in het Amazone-regenwoud
Hoofdlijnen
- Wetenschappers werken aan een periodiek systeem voor ecologie
- Wat is het pad voor voedsel in het spijsverteringsstelsel van konijnen?
- Nieuw onderzoek wijst uit waarom sommige microbiële genen meer promiscue zijn dan andere
- Waren onze tetrapod-voorouders doof?
- Welke organel is verantwoordelijk voor het vasthouden van chemicaliën die nodig zijn om de spijsvertering in een dierlijke cel te houden?
- Kan mariene biologie een hobby zijn?
- Hoeveel morfemen zitten er in het woord biosfeer?
- Geef de naam dat welk zuur aanwezig is in chromosomen?
- Wat is precies een omgekeerd osmosesysteem?
- Blootleggen wat er in tattoo-inkt zit

- NIST breidt database uit die helpt bij het identificeren van onbekende verbindingen in melk
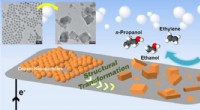
- Koperkatalysator zorgt voor een zeer efficiënte omzetting van CO2 naar brandstoffen
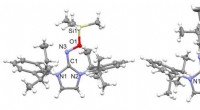
- Radicale moleculen vangen voordat ze verdwijnen
- Nieuwe carrier-doping in p-type halfgeleiders verbetert de prestaties van fotovoltaïsche apparaten door de gatenconcentratie te verhogen

 Het arme Singapore verandert rioolwater in ultraschoon water
Het arme Singapore verandert rioolwater in ultraschoon water Waarin verschilt de JWST van de Hubble?
Waarin verschilt de JWST van de Hubble?  Is er een planeet een miljoen keer groter dan de zon?
Is er een planeet een miljoen keer groter dan de zon?  Wat aten oude krokodillen? Uit onderzoek blijkt dat er zoveel is dat een snuit kan grijpen
Wat aten oude krokodillen? Uit onderzoek blijkt dat er zoveel is dat een snuit kan grijpen  Waarom is diffusie maximaal in gasvormige toestand A -stoffen?
Waarom is diffusie maximaal in gasvormige toestand A -stoffen?  In natte klimaten granietweergoten langzamer dan?
In natte klimaten granietweergoten langzamer dan?  Opstelling en mobiliteit van zachte nanodeeltjes in dichte suspensies
Opstelling en mobiliteit van zachte nanodeeltjes in dichte suspensies Hoe kerstmuziek in advertenties en winkels nostalgie benut om je aan te moedigen meer uit te geven
Hoe kerstmuziek in advertenties en winkels nostalgie benut om je aan te moedigen meer uit te geven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

