
Wetenschap
Welke kleur zijn koper I -complexen?
Dit is waarom:
* Elektronische configuratie: Koper (I) heeft een d
10
Elektronische configuratie, wat betekent dat alle D -orbitalen zijn gevuld. Deze gevulde D-shell voorkomt elektronische overgangen in het zichtbare gebied van het elektromagnetische spectrum, wat leidt tot een gebrek aan kleur.
* Ligand Field -effecten: De kleur van overgangsmetaalcomplexen kan worden beïnvloed door het ligandveld. In Cu (I) -complexen is de splitsing van het ligandveld echter over het algemeen klein vanwege de gevulde D-orbitalen. Dit draagt verder bij aan het gebrek aan kleur.
Uitzonderingen:
Hoewel de meeste Cu (I) -complexen kleurloos zijn, zijn er enkele uitzonderingen waar ze kleur vertonen. Dit is meestal te wijten aan:
* Strong-Field liganden: Liganden zoals cyanide (CN-) en thiocyanaat (SCN-) kunnen significante ligandveldsplitsing veroorzaken, wat resulteert in kleur.
* Banden opladen: Sommige Cu (i) -complexen kunnen kleur vertonen vanwege ladingoverdrachtovergangen van het ligand naar het metaal of vice versa.
Voorbeelden:
* CUCL: Wit vaste stof
* CUBR: Wit vaste stof
* [cu (cn) 2]-: Kleurloze oplossing
* [cu (NH3) 2]+: Kleurloze oplossing
Opmerking: Het is belangrijk om te onthouden dat de kleur van een complex kan worden beïnvloed door factoren zoals concentratie, pH en oplosmiddel.
 Half miljoen krabben gedood door plastic afval op afgelegen eilanden
Half miljoen krabben gedood door plastic afval op afgelegen eilanden Waarom is open -mindedheid belangrijk voor wetenschappers?
Waarom is open -mindedheid belangrijk voor wetenschappers?  Kleverigheid in glaciale ruimte en tijd
Kleverigheid in glaciale ruimte en tijd  Studie:opwarming maakt megadroogte in het westen van de VS de ergste in de moderne tijd
Studie:opwarming maakt megadroogte in het westen van de VS de ergste in de moderne tijd 5 ideeën om de voedselvoorziening ter wereld te verdubbelen
5 ideeën om de voedselvoorziening ter wereld te verdubbelen
Hoofdlijnen
- Glucose en geen andere suiker wordt in cellen getransporteerd door eiwitdragermoleculen in het celoppervlakmembraan. Hoe herkent Glucose specifiek?
- Wat is de progressieve evolutie van ademhalings- en bloedsomloopsystemen in gewervelde dieren?
- Wat is de wetenschappelijke naam voor stalagmieten?
- Afrikaanse pinguïns blijken samen te werken om vissen bijeen te jagen om te foerageren
- Een wetenschapper op televisie stelt dat een hypothese geen toegang kan worden bewezen waarom deze verklaring correct is?
- Biologen onthullen hoe obesitas het skeletspiermetabolisme schaadt
- Kunnen schimmels de grassen van Texas helpen de klimaatverandering het hoofd te bieden?
- Hoe kan stamcelonderzoek de samenleving beïnvloeden?
- Welke binding vormt zich tussen tRNA en mRNA?
- Chemische synthese toont aan dat antibioticum uit de menselijke neus werkt door protontranslocatie
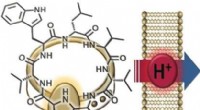
- Wat een zeldzame bloedziekte ons kan leren over bloedstolling
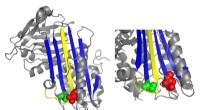
- Fysica van ladingstransport van een unieke klasse van geconjugeerde polymeren met stijve staven
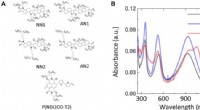
- Studie van olifant, capibara, mensenhaar vindt dat dikker haar niet altijd sterker is

- Dat is slim naaien! Wetenschappers vinden draden uit om gassen te detecteren wanneer ze in kleding worden geweven

 Hoe noem je energie die reist en zich verspreidt terwijl het gaat?
Hoe noem je energie die reist en zich verspreidt terwijl het gaat?  Met de uitbraak van het coronavirus, het maakt uit hoe je je nieuws krijgt
Met de uitbraak van het coronavirus, het maakt uit hoe je je nieuws krijgt Hoe een Tasco Telescope
Hoe een Tasco Telescope Is er een mogelijkheid om een object te laten verdwijnen met behulp van fysica en chemie?
Is er een mogelijkheid om een object te laten verdwijnen met behulp van fysica en chemie?  Is de term cerebrale dominantie het halfrond aan dat dominant is voor taal?
Is de term cerebrale dominantie het halfrond aan dat dominant is voor taal?  Hoe beïnvloeden zwaartekracht en wrijving de rotsen van de rotsen op een berghelling?
Hoe beïnvloeden zwaartekracht en wrijving de rotsen van de rotsen op een berghelling?  Wat zijn geladen atomen als gevolg van verlies of winst van elektronen?
Wat zijn geladen atomen als gevolg van verlies of winst van elektronen?  In welk type natuurkunde is het Higgs -boson betrokken?
In welk type natuurkunde is het Higgs -boson betrokken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

