
Wetenschap
Wat een zeldzame bloedziekte ons kan leren over bloedstolling
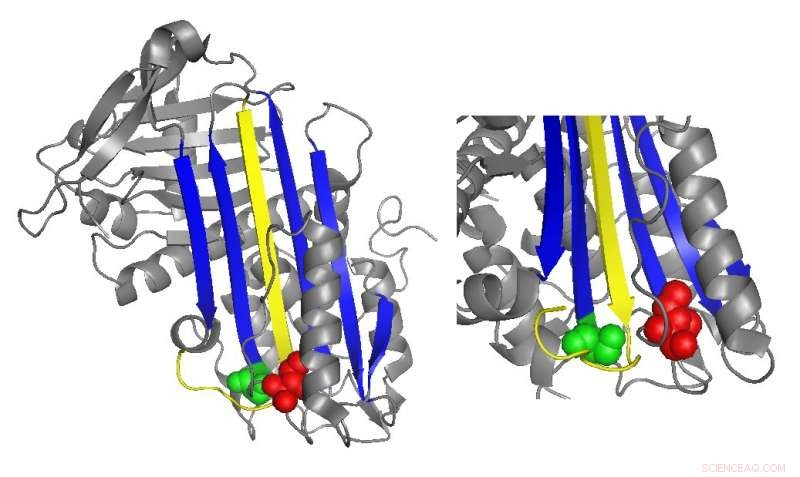
Een lintdiagram van antitrombine markeert locaties van functioneel belangrijke mutaties. Krediet:Irene Martinez-Martinez
Wanneer een persoon gewond raakt, bloedstolling is essentieel. Echter, als het gevaar eenmaal geweken is, het is even essentieel om de stollingsreactie te stoppen om trombose te voorkomen, of de obstructie van de bloedstroom door stolsels. Een eiwit genaamd antitrombine is verantwoordelijk voor het stoppen van de bloedstolling, maar ongeveer één op de tweeduizend mensen heeft een erfelijk tekort aan antitrombine waardoor ze een veel hoger risico lopen op levensbedreigende bloedstolsels.
Een groep onderzoekers in Spanje heeft de mutaties in de antitrombine-eiwitten van deze patiënten geanalyseerd en ontdekt dat een deel van het eiwit een onverwachte rol speelt in zijn functie. Dit inzicht in hoe antitrombine werkt, zou kunnen leiden tot behandelingen, niet alleen voor patiënten met antitrombinedeficiëntie, maar ook naar beter ontworpen medicijnen voor andere bloedaandoeningen. Het onderzoek zal worden gepubliceerd in het 6 oktober nummer van de Tijdschrift voor biologische chemie .
Het Centro Regional de Hemodonacion en Hospital Universitario Morales Meseguer van de Universidad de Murcia in Spanje is een referentiecentrum voor de diagnose van antitrombinedeficiëntie. Al meer dan 15 jaar, onderzoekers van het laboratorium hebben monsters ontvangen van patiënten met verschillende mutaties die van invloed zijn op hoe hun antitrombine werkt.
Antitrombine remt normaal gesproken trombine door een lusvormig gebied in te brengen, de reactieve middenlus genoemd, in de actieve plaats van het trombine-eiwit, voorkomen dat trombine de vorming van stolsels katalyseert door de vorm van de actieve plaats van het trombine te vervormen. Veel antitrombinemutaties die stollingsziekten veroorzaken, hebben direct of indirect invloed op de reactieve centrale lus. Echter, biochemische studies onder leiding van Irene Martinez-Martinez ontdekten dat mutaties in een heel ander deel van het antitrombine ook bijdroegen aan de disfunctie ervan.
"We zagen dat we mutanten [hadden] die de functie van het eiwit beïnvloedden, ook al waren ze ver verwijderd van het belangrijkste deel van het eiwit dat verantwoordelijk is voor de remming, " zei Martinez-Martinez. "Mensen dachten dat de antitrombinefunctie voornamelijk gericht was op één domein van het eiwit. Met dit werk, we hebben ons gerealiseerd dat dat niet waar is."
De analyses van de onderzoekers van de nieuwe mutaties suggereerden dat het domein van het antitrombine aan het andere uiteinde van de reactieve centrale lus helpt om het trombine opgesloten te houden in zijn laatste, vervormde vorm. Wanneer er specifieke mutaties waren in deze regio, het trombine was vaker in staat om terug te keren naar zijn actieve vorm en het antitrombine af te breken en af te geven.
Martinez-Martinez hoopt dat het begrijpen van het belang van deze regio van de antitrombine kan leiden tot betere medicijnen voor het voorkomen van bloedstolling door antitrombine te activeren of het voorkomen van bloedingen door het te remmen. Ze benadrukt ook dat de essentiële aard van dit domein van het eiwit niet kon worden voorspeld door simpelweg de sequenties van gezonde antitrombines te bestuderen.
"Dit werk is mogelijk gemaakt dankzij de karakterisering van mutaties die zijn geïdentificeerd bij patiënten, ', aldus Martinez-Martinez.
Het werk werd gefinancierd door de stichtingen Instituto de Salud Carlos III en FEDER, evenals Fundación Séneca.
 Wat is een veilige GPU-temperatuur voor een laptop?
Wat is een veilige GPU-temperatuur voor een laptop?  Nieuwe verbindingen uit de zeester van het Kuril-bekken tonen werkzaamheid tegen kankercellen.
Nieuwe verbindingen uit de zeester van het Kuril-bekken tonen werkzaamheid tegen kankercellen. Organische kristallen ijsvormende superkrachten
Organische kristallen ijsvormende superkrachten Nieuwe technologie heeft tot doel de levensduur van lithium-metaalbatterijen te verbeteren, veiligheid
Nieuwe technologie heeft tot doel de levensduur van lithium-metaalbatterijen te verbeteren, veiligheid Wetenschapsproject over hoe een ei te drijven
Wetenschapsproject over hoe een ei te drijven
 Monitoringsysteem beschermt proefgewassen
Monitoringsysteem beschermt proefgewassen Gevriesdroogde grond is meer geschikt voor het bestuderen van reactieve stikstofgasemissies in de bodem
Gevriesdroogde grond is meer geschikt voor het bestuderen van reactieve stikstofgasemissies in de bodem Orkaan Olaf verzwakt boven het Mexicaanse schiereiland Baja California
Orkaan Olaf verzwakt boven het Mexicaanse schiereiland Baja California Arctische zee-ijsdips worden laag voor de winter (update)
Arctische zee-ijsdips worden laag voor de winter (update) Hoe zorgen pijlstaartroggen voor hun jongen
Hoe zorgen pijlstaartroggen voor hun jongen
Hoofdlijnen
- CRISPR gebruiken om warmer te maken, minder vette varkens
- Cryo-EM-beeldvorming suggereert hoe de dubbele helix scheidt tijdens replicatie
- Vleugelafdrukken kunnen individuele vleermuizen net zo effectief identificeren als vingerafdrukken mensen identificeren
- Dit wetenschappelijke experiment duurt 500 jaar
- Virussen bestrijden:codebrekers worden codeschrijvers
- Wetenschappers ontwikkelen aardnoot die resistent is tegen aflatoxine
- Wat hebben alle levende organismen gemeen?
- Wat is het voordeel van het gebruik van vlekken om naar cellen te kijken?
- Grootste genetische studie van muggen onthult verspreiding van resistentie tegen insecticiden in Afrika
- Onderzoekers onderzoeken energiebesparende katalysatoren die werken bij kamertemperatuur

- Onderzoekers ontwikkelen een rekrek voor cellen

- De gemiddelde jaartemperatuur berekenen

- Nieuw waargenomen eenwaardige calciumionen vertonen onverwachte metaalachtigheid en ferromagnetisme
- Atomen in grammen omrekenen met een rekenmachine

 Mistharp vergroot opvangcapaciteit voor schoon water
Mistharp vergroot opvangcapaciteit voor schoon water Hoe beïnvloeden oceaanstromingen het weer in het binnenland?
Hoe beïnvloeden oceaanstromingen het weer in het binnenland?  Hoe de Mars Curiosity Rover werkt
Hoe de Mars Curiosity Rover werkt  NASA ziet Iris de Zombie Storm herboren in de buurt van Queensland
NASA ziet Iris de Zombie Storm herboren in de buurt van Queensland Stijgende zeeën forceren duin- en strandbeweging
Stijgende zeeën forceren duin- en strandbeweging Nieuw onderzoek creëert neutraliserende spons voor gevaarlijke chemicaliën
Nieuw onderzoek creëert neutraliserende spons voor gevaarlijke chemicaliën Nieuwe warme Neptunus exoplaneet ontdekt
Nieuwe warme Neptunus exoplaneet ontdekt Röntgenpistool helpt onderzoekers de oorsprong van aardewerk op oude scheepswrakken te achterhalen
Röntgenpistool helpt onderzoekers de oorsprong van aardewerk op oude scheepswrakken te achterhalen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

