
Wetenschap
Welke heeft de hoogste elektronenversterking en enthalpie tussen chloor en fluor waarom?
Verklaring:
* Elektronenversterking enthalpie is de verandering in energie die optreedt wanneer een elektron wordt toegevoegd aan een neutraal atoom in de gasvormige toestand om een negatief ion te vormen.
* Grootte: Fluor is kleiner in grootte dan chloor. Als gevolg hiervan ervaart het toegevoegde elektron in fluor een sterkere aantrekkingskracht van de kern, wat leidt tot een grotere afgifte van energie.
* Inter-Electronic Repulsions: In fluor wordt het inkomende elektron toegevoegd aan de 2p orbital, die al half gevuld is. Dit resulteert in grotere interelectronische afstotingen, waardoor het minder gunstig is om nog een elektron toe te voegen. In chloor gaat het toegevoegde elektron in een 3P -orbitaal, dat minder druk is, wat leidt tot minder afstotingen.
* Effectieve nucleaire lading: Hoewel fluor een hogere nucleaire lading heeft, ervaren de elektronen in de 2P -orbitalen van fluor een sterker afschermingseffect van de binnenste elektronen in vergelijking met chloor. Dit vermindert de effectieve nucleaire lading die wordt ervaren door het toegevoegde elektron in fluor.
Daarom, ondanks dat fluor meer elektronegatief is, heeft chloor een hogere elektronenversterking enthalpie vanwege de grotere omvang, lagere inter-electronische afstotingen en een iets hogere effectieve nucleaire lading ervaren door het toegevoegde elektron.
Opmerking: De elektronenversterking enthalpie van fluor is nog steeds zeer exotherme, maar het is minder exotherme dan die van chloor.
Hoofdlijnen
- Biologen Schleiden en Schwann zouden dat beweren. alle cellen komen van andere de kleinste levende eenheid is cel dingen bestaan uit a of hoger?
- Plantverdediging volgens het iron-maiden-principe
- Wat zijn twee gemeenschappelijke kenmerken van schimmelachtige protisten?
- Wat zijn functies van eiwitten?
- Wat is de theorie achter genbanden?
- Tot welk belangrijk weefsel behoort bloed?
- Op de loer in genomische schaduwen:hoe gigantische virussen de evolutie van algen voeden
- Cheerleading Science Fair Project Ideas
- Mitochondria is een voorbeeld van een?
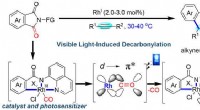
- Zichtbaar licht-geïnduceerde bifunctionele rhodium katalyse ontwikkeld voor decarbonylatieve koppeling van imiden met alkynen
- Onderzoekers hopen naaldprikken voor diabetici tot het verleden te maken

- De structuur van ATP-synthase oplossen

- Moleculaire films werpen licht op het enzym dat betrokken is bij de productie van broeikasgassen
- Wetenschappers ontwikkelen breedspectrumremmers van het griepvirus
 Welke vlag heeft slechts twee sterren?
Welke vlag heeft slechts twee sterren?  Hoe de verandering in temperatuur te berekenen
Hoe de verandering in temperatuur te berekenen Recyclingexperts bereiken mijlpaal in zoektocht naar afvalvrije telefoon
Recyclingexperts bereiken mijlpaal in zoektocht naar afvalvrije telefoon Hoe is de persoon die de fysieke wetenschap bestudeert?
Hoe is de persoon die de fysieke wetenschap bestudeert?  De globale puls voor elektrische voertuigen controleren
De globale puls voor elektrische voertuigen controleren Welk type baan moeten de planeten rond de zon draaien?
Welk type baan moeten de planeten rond de zon draaien?  Nieuw onderzoek laat zien hoe COVID-19 de intenties van Amerikanen om te verhuizen veranderde
Nieuw onderzoek laat zien hoe COVID-19 de intenties van Amerikanen om te verhuizen veranderde  Vogelbiodiversiteit in kaart brengen vanuit de ruimte?
Vogelbiodiversiteit in kaart brengen vanuit de ruimte?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


