
Wetenschap
Als zwavel een atoomnummer van 16 heeft. Hoeveel covalente bindingen kunnen vormen?
* Elektronenconfiguratie: Zwavel heeft een elektronenconfiguratie van 1S² 2S² 2P⁶ 3S² 3P⁴. Dit betekent dat het 6 elektronen heeft in zijn buitenste schaal (de 3e schaal).
* valentie -elektronen: Valentie -elektronen zijn de elektronen in de buitenste schaal die deelnemen aan binding. Zwavel heeft 6 valentie -elektronen.
* octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie van 8 elektronen in hun buitenste schaal (octetregel) te bereiken.
* binding: Om een octet te bereiken, moet zwavel nog 2 elektronen krijgen. Dit betekent dat het twee covalente bindingen kan vormen door twee van zijn elektronen te delen met andere atomen.
Voorbeelden:
* In waterstofsulfide (H₂S) vormt zwavel twee enkele covalente bindingen met twee waterstofatomen.
* In zwaveldioxide (SO₂) vormt zwavel een dubbele covalente binding met elk zuurstofatoom.
Laat het me weten als je nog andere chemische vragen hebt!
 Machine learning versnelt de ontdekking van hoogwaardige metaaloxidekatalysatoren
Machine learning versnelt de ontdekking van hoogwaardige metaaloxidekatalysatoren  Voorbeelden van zuurbuffers
Voorbeelden van zuurbuffers  Onderzoekers ontwerpen transistors op basis van ionische gel gemaakt van een geleidend polymeer
Onderzoekers ontwerpen transistors op basis van ionische gel gemaakt van een geleidend polymeer WH zijn koolstof en silicium terughoudend om ionische bindingen te vormen?
WH zijn koolstof en silicium terughoudend om ionische bindingen te vormen?  Wat is ethylelektro-negativiteit?
Wat is ethylelektro-negativiteit?
 Hoe is een persoon die land ontvangt?
Hoe is een persoon die land ontvangt?  Noord-Koreaanse seismische gebeurtenis van mei 2010 was waarschijnlijk een aardbeving, geen kernproef
Noord-Koreaanse seismische gebeurtenis van mei 2010 was waarschijnlijk een aardbeving, geen kernproef NASA ziet recordbrekende nieuwe tropische storm Gonzalo versterken
NASA ziet recordbrekende nieuwe tropische storm Gonzalo versterken Is familie van belang in het bedrijfsleven? Studie evalueert het eigenaarschap van de milieustrategieën van bedrijven
Is familie van belang in het bedrijfsleven? Studie evalueert het eigenaarschap van de milieustrategieën van bedrijven  Enorme behoefte aan groeiende bomen op boerderijen
Enorme behoefte aan groeiende bomen op boerderijen
Hoofdlijnen
- Welk proces gebruiken wetenschappers om wetenschappelijk onderzoek uit te voeren?
- Wat is de naam van het mechanisme dat betrokken is bij het normaal houden van lichaamssystemen?
- Hoe krijgen eencellige organismen water?
- Biologen maken kever met functioneel extra oog
- Killer-tandpijn veroorzaakt waarschijnlijk ellende voor orka's in gevangenschap
- Waar bevindt DNA zich in de cel?
- Genen die samenkomen met verschillende allelen worden hoe genoemd?
- Gewone schimmel helpt het knokkelkoortsvirus te gedijen bij muggen
- Uitsterven dreigt voor twee zeldzame vogelsoorten na verwoestende orkanen
- De geboorte van een nieuw eiwit
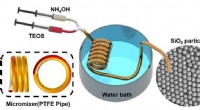
- Wetenschappers gebruiken een teflonpijp om een goedkope, eenvoudige reactor voor de synthese van silicadeeltjes
- Hoe het proces van polymeerextrusie te optimaliseren

- Productie van open-mesoporeuze koolstofnanovezels voor flexibele en draagbare stroombronnen

- Doorbraak kan organische elektronica lanceren buiten de schermen van mobiele telefoons

 Video:Ontbossing vertragen is de sleutel tot het voorkomen van de volgende pandemie - maar wat kost dat?
Video:Ontbossing vertragen is de sleutel tot het voorkomen van de volgende pandemie - maar wat kost dat? Tweets vertellen wetenschappers hoe snel we ongebruikelijk weer normaliseren
Tweets vertellen wetenschappers hoe snel we ongebruikelijk weer normaliseren Wetenschappers zeggen dat Malpelo-microtiterplaat helpt bij het oplossen van geologische misfit onder de Stille Oceaan
Wetenschappers zeggen dat Malpelo-microtiterplaat helpt bij het oplossen van geologische misfit onder de Stille Oceaan Primates of the Caribbean:oud DNA onthult geschiedenis van mysterieuze aap
Primates of the Caribbean:oud DNA onthult geschiedenis van mysterieuze aap Zullen brein-computerinterfaces kennis stroombaar maken?
Zullen brein-computerinterfaces kennis stroombaar maken?  Beschrijf de samengestelde microscoop die is ontwikkeld door Zaccharias en Hans Janssen?
Beschrijf de samengestelde microscoop die is ontwikkeld door Zaccharias en Hans Janssen?  Onderzoekers rapporteren nieuwe hybride katalysator om water te splitsen
Onderzoekers rapporteren nieuwe hybride katalysator om water te splitsen Burgerwetenschappers verdienen meer krediet, onderzoekers beweren:
Burgerwetenschappers verdienen meer krediet, onderzoekers beweren:
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

