
Wetenschap
Wat is de actie van H2O2 op KMNO4?
Algemene reactie:
In zure omstandigheden is de reactie een redoxreactie waarbij permanganaationen (MNO₄⁻) worden gereduceerd tot mangaan (II) ionen (Mn²⁺) en waterstofperoxide wordt geoxideerd tot zuurstofgas (O₂).
Vereenvoudigde vergelijking:
2kmno₄ + 3H₂o₂ + 3H₂SO₄ → K₂so₄ + 2mnso₄ + 8h₂o + 3o₂
Verklaring:
* Vermindering van permanganaat: Het permanganaat -ion (MNO₄⁻) werkt als een oxidatiemiddel, wint elektronen en wordt gereduceerd tot Mn²⁺.
* oxidatie van waterstofperoxide: Waterstofperoxide (H₂o₂) werkt als een reductiemiddel, het verliezen van elektronen en worden geoxideerd tot O₂.
* Zure omstandigheden: De reactie heeft een zure omgeving nodig, meestal geleverd door zwavelzuur (h₂so₄), om de vermindering van permanganaat door te gaan.
belangrijke opmerkingen:
* reactiesnelheid: De reactiesnelheid wordt beïnvloed door factoren zoals temperatuur, concentratie van reactanten en de aanwezigheid van katalysatoren.
* nevenreacties: In sommige gevallen kunnen andere mangaansoorten, zoals MNO₂ (mangaandioxide), worden gevormd als bijproducten.
* Veiligheidsoverwegingen: Deze reactie is exotherme en kan krachtig zijn. Er moet voorzichtig zijn bij het hanteren van deze chemicaliën.
Toepassingen:
Deze reactie heeft verschillende toepassingen, waaronder:
* Analytische chemie: Gebruikt voor de titratie van waterstofperoxide om de concentratie ervan te bepalen.
* Organische chemie: Gebruikt als oxidatiemiddel in verschillende organische reacties.
* Milieuchemie: Gebruikt bij de sanering van besmet water.
Samenvattend is de reactie tussen H₂o₂ en KMNO₄ een complex redoxproces waarbij permanganaat wordt verminderd en waterstofperoxide wordt geoxideerd, waardoor mangaan (II) ionen, zuurstofgas en andere producten worden gegenereerd, afhankelijk van de omstandigheden.
 Tyrosinechassis voor duurzame productie met hoog rendement van nuttige verbindingen in slimme gistcellen
Tyrosinechassis voor duurzame productie met hoog rendement van nuttige verbindingen in slimme gistcellen Kun je me een voorbeeld geven van koken?
Kun je me een voorbeeld geven van koken?  Wanneer een stof wordt verwarmd, hoe heet dat dan?
Wanneer een stof wordt verwarmd, hoe heet dat dan?  Hoeveel waterstof- en koolstofatomen worden gemaakt in 5 moleculen van dioxide?
Hoeveel waterstof- en koolstofatomen worden gemaakt in 5 moleculen van dioxide?  Hoeveel atomen en zijn er in 36 g water?
Hoeveel atomen en zijn er in 36 g water?
 Opzetten van een alarmsysteem in de Atlantische Oceaan
Opzetten van een alarmsysteem in de Atlantische Oceaan Onderzoek toont een versnelling van de wereldgemiddelde oceaancirculatie sinds de jaren negentig aan
Onderzoek toont een versnelling van de wereldgemiddelde oceaancirculatie sinds de jaren negentig aan Wat is de ware aard van het 'Matildas-effect'? Nieuw onderzoek toont aan dat dit diepgaand, maar ongelijkmatig is
Wat is de ware aard van het 'Matildas-effect'? Nieuw onderzoek toont aan dat dit diepgaand, maar ongelijkmatig is  De omgeving verbeteren:wanneer oplossingen problemen worden
De omgeving verbeteren:wanneer oplossingen problemen worden Welke rol spelen schimmels in voedselketens?
Welke rol spelen schimmels in voedselketens?
Hoofdlijnen
- Hoe kunnen wetenschappers uitleg over gegevens ontwikkelen?
- Waarom gebruiken artsen wetenschappelijke notatie?
- Hoe vergelijk ik Frankenstein & Cloning?
- Hoe kleine watermonsters echt grote dieren kunnen vinden
- Onderzoeken hoe cellen met elkaar praten
- Wat doet een twiner van STEM?
- De morfologie van algen
- Hebben Google en Facebook de plicht om desinformatie te vernietigen?
- Wat voor soort organismen groeien er onder rotsen op Red en leven misschien zelfs op Mars?
- Nieuwe isolatietechniek maakt de weg vrij voor krachtigere en kleinere spanen
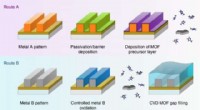
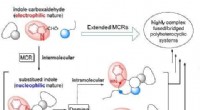
- Nieuwe multicomponent reactiegrenzen
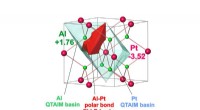
- Een elektrokatalysator voor de reactie van zuurstofontwikkeling bij het splitsen van water
- Gels gemaakt van druppeltjes zijn minder stabiel dan gels gemaakt van vaste deeltjes

- Ferro-elektrische zelf-geassembleerde moleculaire materialen

 Gestandaardiseerde waarden zoeken voor correlatie
Gestandaardiseerde waarden zoeken voor correlatie Waarom de Appalachian Mountains soepel en afgerond?
Waarom de Appalachian Mountains soepel en afgerond?  Draagt koude natuurbrandrook bij aan waterafstotende bodems in verbrande gebieden?
Draagt koude natuurbrandrook bij aan waterafstotende bodems in verbrande gebieden?  Hoe een verandering in potentiële energie berekenen
Hoe een verandering in potentiële energie berekenen  Waarom wetenschappelijk toezicht op de effectenindustrie op onbetaalbare WA-rotskunst ontoereikend is
Waarom wetenschappelijk toezicht op de effectenindustrie op onbetaalbare WA-rotskunst ontoereikend is  Smeltende gletsjers kunnen de CO2-uitstoot in de atmosfeer versnellen
Smeltende gletsjers kunnen de CO2-uitstoot in de atmosfeer versnellen Alles-afstotende coating kan telefoons kinderveilig maken, huizen
Alles-afstotende coating kan telefoons kinderveilig maken, huizen Welke waterlichamen scheiden het Amerikaanse Britse grondgebied naar het noorden?
Welke waterlichamen scheiden het Amerikaanse Britse grondgebied naar het noorden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

