
Wetenschap
Welke elementen vormen precies meerdere ionen?
Hier is een uitsplitsing:
* Oxidatietoestand: Een oxidatietoestand (of oxidatienummer) vertegenwoordigt de hypothetische lading die een atoom zou hebben als al zijn obligaties 100% ionisch waren.
* ionen: Ionen zijn atomen of moleculen die elektronen hebben gewonnen of verloren, wat resulteert in een netto positieve of negatieve lading.
elementen die meerdere oxidatietoestanden vertonen, zijn voornamelijk die gevonden in de overgangsmetalen (groepen 3-12), en niet-metalen, met name die in groepen 14-17.
Waarom hebben deze elementen meerdere oxidatietoestanden?
* Elektronenconfiguratie: Deze elementen hebben vaak gedeeltelijk gevulde D- of P -orbitalen in hun buitenste schaal, waardoor ze kunnen verliezen of verschillende aantal elektronen kunnen krijgen.
* Chemische omgeving: De specifieke oxidatietoestand die een element aanneemt, hangt af van de andere atomen waaraan het is verbonden en de algehele chemische omgeving.
Bijvoorbeeld:
* ijzer (Fe): Kan oxidatietoestanden van +2 (Fe²⁺) en +3 (Fe³⁺) hebben.
* koper (cu): Kan oxidatietoestanden van +1 (Cu⁺) en +2 (Cu²⁺) hebben.
* chloor (CL): Kan oxidatietoestanden van -1 (Cl⁻), +1 (Cl⁺), +3 (Cl³⁺), +5 (Cl⁵⁺) en +7 (Cl⁷⁺) hebben.
Het is belangrijk om te onthouden:
* De vorming van specifieke ionen hangt af van de chemische reactie die plaatsvindt.
* Niet alle elementen vertonen meerdere oxidatietoestanden. Alkali -metalen (groep 1) hebben bijvoorbeeld meestal een +1 oxidatietoestand, terwijl alkalische aardmetalen (groep 2) meestal een +2 oxidatietoestand hebben.
Laat het me weten als je meer details wilt over specifieke elementen en hun gemeenschappelijke oxidatietoestanden!
 Wat is de moleculaire formule van een verbinding met een empirische Ch?
Wat is de moleculaire formule van een verbinding met een empirische Ch?  Onderzoek naar het effect van ringsluiting op de fluorescentie van supramoleculaire polymeren
Onderzoek naar het effect van ringsluiting op de fluorescentie van supramoleculaire polymeren  Hoe extraheren zoute zeep en ethanol DNA?
Hoe extraheren zoute zeep en ethanol DNA?  Hoeveel atomen zijn aanwezig in 4.2 mol aluminium?
Hoeveel atomen zijn aanwezig in 4.2 mol aluminium?  Wat is de chemische vergelijking als zoutzuur aan calciumhydroxide wordt toegevoegd?
Wat is de chemische vergelijking als zoutzuur aan calciumhydroxide wordt toegevoegd?
Hoofdlijnen
- Centriole: definitie, functie en structuur
- Wat zijn de bepalende kenmerken van materie?
- Wat is de term voor uitwisseling van genetisch materiaal tussen bacteriën via contactpersonen?
- Het visfeest is in wezen een benzinestation en trekt zeeleeuwen naar Pier 39 in aantallen die in 15 jaar niet meer zijn gezien
- Boren koolhydraten erfelijke informatie op en verzenden ze erfelijke informatie?
- Geit sterft voor het eerst in de VS aan vogelgriep, zeggen ambtenaren van Minnesota:waarom het 'significant' is
- Hoe leren ziekteverwekkers ziekteverwekkers te zijn:partnerschappen tussen microben die leiden tot ziekte bij de mens
- Hoe werden aminozuren, een van de belangrijkste bouwstenen van het leven, gevormd voordat het leven op aarde ontstond?
- De vier eigenschappen van spiercellen
- Nieuwe genetische methode verbetert de efficiëntie van het enzym

- Chemische ingenieurs publiceren paper waarin theorieën over glasovergang worden uitgedaagd

- Structuur van elektrolyt regelt batterijprestaties
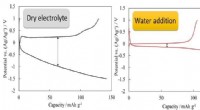
- Onderzoeker maakt 3D-geprint multimateriaal met geprogrammeerde stijfheid

- Historische films kunnen dankzij het azijnsyndroom veel sneller vergaan dan we dachten

 Orkaan Julia 2022
Orkaan Julia 2022  Mijnwerkers vinden roze diamant waarvan wordt aangenomen dat deze de grootste in 300 jaar is gezien
Mijnwerkers vinden roze diamant waarvan wordt aangenomen dat deze de grootste in 300 jaar is gezien Hoe vroeg komt de lente bij jou in de buurt? Er achter komen ...
Hoe vroeg komt de lente bij jou in de buurt? Er achter komen ... Ontwerp voor overstromingen:hoe steden ruimte kunnen maken voor water
Ontwerp voor overstromingen:hoe steden ruimte kunnen maken voor water Waarom worden bladeren op een boom in de lente groen van boven naar beneden?
Waarom worden bladeren op een boom in de lente groen van boven naar beneden?  WHO zegt dat luchtvervuiling 7 miljoen doden per jaar kost, verscherpt richtlijnen
WHO zegt dat luchtvervuiling 7 miljoen doden per jaar kost, verscherpt richtlijnen Nieuwe materialen met belangrijke toepassingen in verbeterde oliewinning
Nieuwe materialen met belangrijke toepassingen in verbeterde oliewinning Wat is de hoogste top ter wereld?
Wat is de hoogste top ter wereld?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

