
Wetenschap
De elektronenconfiguraties van de edelgassen van neon tot radon in periodieke tabel maken deze elementen deel de?
Dit is waarom:
* Nobele gaselektronenconfiguraties: Nobele gassen hebben hun buitenste elektronenschil volledig gevuld met elektronen. Dit geeft hen uitzonderlijke stabiliteit en lage reactiviteit.
* P-block-elementen: De P-block-elementen zijn die met hun buitenste elektron in een P-Orbital. Nobele gassen vullen, met uitzondering van helium, hun p-orbitalen volledig.
Laten we eens kijken naar voorbeelden:
* neon (ne): 1S² 2S² 2P⁶ (p-orbital gevuld)
* argon (AR): 1S² 2S² 2P⁶ 3S² 3P⁶ (p-orbitaal gevuld)
* Krypton (KR): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ (p-orbitaal gevuld)
* xenon (xe): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ 5S² 4D¹⁰ 5P⁶ (p-orbitaal gevuld)
* radon (RN): 1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P⁶ 5S² 4D¹⁰ 5P⁶ 6S² 4F¹⁴ 5d¹⁰ 6p⁶ (p-orbitaal gevuld)
Daarom zijn de edelgassen van neon tot radon allemaal geclassificeerd als p-block elementen Vanwege hun gevulde P-orbitalen in hun buitenste elektronenschil.
 Waarom treedt er opnieuw een kleurverandering op na het eindpunt van de titratie van natriumthiosulfaat met jodium?
Waarom treedt er opnieuw een kleurverandering op na het eindpunt van de titratie van natriumthiosulfaat met jodium?  Welk volume waterstof in L wordt geproduceerd uit de volledige reactie van 3143 molkenzuur 3143 mol bij STP mg S 2HCl aq mgcl2 H2 g?
Welk volume waterstof in L wordt geproduceerd uit de volledige reactie van 3143 molkenzuur 3143 mol bij STP mg S 2HCl aq mgcl2 H2 g?  Wat is het verschil tussen pangaea en panthalasa?
Wat is het verschil tussen pangaea en panthalasa?  Is kleurloos gas een chemische eigenschap?
Is kleurloos gas een chemische eigenschap?  Hoe worden groep 7 verbindingen gebruikt in röntgenfotografie en landbouw?
Hoe worden groep 7 verbindingen gebruikt in röntgenfotografie en landbouw?
 86% van het zwerfvuil in de Grote Meren bestaat uit plastic, zo blijkt uit 20 jaar durend onderzoek:en het plastic wordt alleen maar kleiner en kleiner.
86% van het zwerfvuil in de Grote Meren bestaat uit plastic, zo blijkt uit 20 jaar durend onderzoek:en het plastic wordt alleen maar kleiner en kleiner.  Welke twee continenten liggen volledig op het zuidelijk halfrond?
Welke twee continenten liggen volledig op het zuidelijk halfrond?  Verdrinkingsangsten in het westen van de VS terwijl rivieren deinen met smeltende sneeuw
Verdrinkingsangsten in het westen van de VS terwijl rivieren deinen met smeltende sneeuw Chlorose is het fenomeen waar bladeren hebben?
Chlorose is het fenomeen waar bladeren hebben?  Ozonlimieten spelen een rol als EPA, industrie en milieugroepen wegen in
Ozonlimieten spelen een rol als EPA, industrie en milieugroepen wegen in
Hoofdlijnen
- De aandelen van Facebook zinken, dus wie moet het kopen?
- Wat zijn de vier belangrijkste elementen van levende organismen?
- Hoe heet het met vloeistof gevulde dunne weefsel dat zich rondom het embryo ontwikkelt?
- Hoe is een Cells DNA net als de boeken in een bibliotheek?
- Nieuwe liaansoorten gemeld uit Tibet
- Hersendood hoe werkt
- Wat is de samenstellende vorm van AB?
- Zijn fysieke overeenkomsten de enige eigenschappen die worden gebruikt om het organisme te classificeren?
- Houden hekserijovertuigingen de economische vooruitgang tegen?
- Farmacoscopie maakt immunomodulerende geneesmiddelenontdekking mogelijk door immuuncelinteracties te analyseren

- Onderzoeksteam pioniert sneller, goedkopere en groenere manier om aminozuren te produceren uit plantaardig afval

- Doorbrekende symmetrie leidt tot responsieve organische fotodetectoren
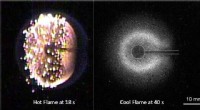
- Koele vlammen ontstoken in de ruimte
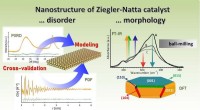
- Opheldering van nanostructuren in praktische heterogene katalysatoren
 Op weg naar intelligente microrobots
Op weg naar intelligente microrobots Wat wordt bedoeld met opeenvolgende botsingen?
Wat wordt bedoeld met opeenvolgende botsingen?  Los Angeles test verkoelende bestratingsverf om hitte te verslaan
Los Angeles test verkoelende bestratingsverf om hitte te verslaan Een vooruitgang in het maken van moleculaire films laat zien hoe moleculen reageren op twee fotonen van licht
Een vooruitgang in het maken van moleculaire films laat zien hoe moleculen reageren op twee fotonen van licht  EU-consumentenchef ongeduldig met Facebook over data
EU-consumentenchef ongeduldig met Facebook over data Grote impact, klein element - waterstofenergie op nanoschaal
Grote impact, klein element - waterstofenergie op nanoschaal Vijf nieuwe hydrothermale bronnen ontdekt in de oostelijke tropische Stille Oceaan
Vijf nieuwe hydrothermale bronnen ontdekt in de oostelijke tropische Stille Oceaan  Waar komen haarcellen daar nuritioment vandaan?
Waar komen haarcellen daar nuritioment vandaan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

