
Wetenschap
Vergelijk de magnitudes van dipool-dipoolkrachten tussen deeltjes een stof in vloeibare toestand met gasvormige toestand?
* Afstand: In de vloeibare toestand zijn moleculen veel dichter bij elkaar dan in de gasvormige toestand. Dipool-dipoolkrachten zijn omgekeerd evenredig met de afstand tussen moleculen. Dit betekent dat naarmate de afstand afneemt (zoals in een vloeistof), de sterkte van de kracht toeneemt.
* Moleculaire beweging: Gasmoleculen bewegen veel sneller en willekeuriger dan vloeibare moleculen. Deze verhoogde beweging in gassen verstoort de afstemming van dipolen, waardoor de dipool-dipoolinteracties worden verzwakt. In vloeistoffen zorgt de langzamere beweging mogelijk voor meer consistente uitlijning en sterkere interacties.
* Dichtheid: Vloeistoffen zijn veel dichter dan gassen, wat betekent dat er meer moleculen in een bepaalde ruimte zijn verpakt. Deze hogere dichtheid leidt tot frequentere en sterkere dipool-dipoolinteracties.
Samenvattend: De nadere nabijheid, verminderde moleculaire beweging en hogere dichtheid van moleculen in de vloeibare toestand dragen allemaal bij aan sterkere dipool-dipoolkrachten in vergelijking met de gasvormige toestand.
 Welk soort kracht kan dingen aantrekken?
Welk soort kracht kan dingen aantrekken?  Welk dier is de aaseter in een voedselketen?
Welk dier is de aaseter in een voedselketen?  Wat zit er in een naam als het om orkanen gaat?
Wat zit er in een naam als het om orkanen gaat?  Wat produceert een afbeelding van een exemplaar door er zichtbaar licht doorheen te geven?
Wat produceert een afbeelding van een exemplaar door er zichtbaar licht doorheen te geven?  Gesprekken met planten:kunnen we planten vooraf waarschuwen voor dreigende gevaren?
Gesprekken met planten:kunnen we planten vooraf waarschuwen voor dreigende gevaren?
Hoofdlijnen
- Sour Patch-volwassenen:1 op de 8 volwassenen houdt van extreme zuurheid, blijkt uit onderzoek
- Is teamwetenschap productief? Studie meet het collaboratieve karakter van translationele geneeskunde
- Welke verklaring beschrijft een wetenschappelijke theorie?
- Biologen ontsluiten 'black box' naar de ondergrondse wereld:onderzoek toont aan hoe kleine microben het leven van mensen gemakkelijker maken
- Wat betekent ‘Kaukasisch’ werkelijk?
- Wat is de nucleaire verdeling die het chromosoomnummer vermindert?
- Welke structuur vertelt u dat Euglena getoont een autotrofe is?
- Welk proces wordt dit genoemd wanneer cellen het plasmamembraan binnenkomen?
- Wat is buiten de endodermis die verticale wortels ontwikkelt?
- Afvalwater gereinigd dankzij een nieuw adsorberend materiaal gemaakt van fruitschillen
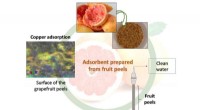
- Menselijke gevaren belemmeren onderzoek naar gif van vampiervleermuizen

- Technologie verandert smartphones in on-the-spot detectoren voor door voedsel overgedragen ziekten, andere gevaarlijke verontreinigingen

- Chemici ontdekken sleutel tot groenere voedselproductie

- Wetenschappers ontwikkelen nieuwe, snelle pijplijn voor antimicrobiële stoffen
 Is eclips gelijk aan nacht in het plantenleven? Onderzoekers testen plantritmes tijdens zonsverduistering
Is eclips gelijk aan nacht in het plantenleven? Onderzoekers testen plantritmes tijdens zonsverduistering Zoektocht om het wereldwijde waterplantmysterie op te lossen
Zoektocht om het wereldwijde waterplantmysterie op te lossen Welke van de aardlagen is in verschillende stukken gebroken?
Welke van de aardlagen is in verschillende stukken gebroken?  Welke compound zou zich vormen van Ca Plus 2 en CL?
Welke compound zou zich vormen van Ca Plus 2 en CL?  Verloren continent Zeelandia:wetenschappers keren terug van expeditie naar gezonken land
Verloren continent Zeelandia:wetenschappers keren terug van expeditie naar gezonken land Hoe Maglev-treinen werken
Hoe Maglev-treinen werken  Het openen van communicatielijnen tussen voortstuwing en luchtstroom stelt nieuwe vragen
Het openen van communicatielijnen tussen voortstuwing en luchtstroom stelt nieuwe vragen Hoe weten astronomen dat waterstof aanwezig is in bijna elke ster het universum?
Hoe weten astronomen dat waterstof aanwezig is in bijna elke ster het universum?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

