
Wetenschap
Welke informatie wordt gegeven door een moleculaire formule?
* De soorten atomen aanwezig: Het vermeldt de elementen waaruit het molecuul bestaat met behulp van hun chemische symbolen.
* Het nummer van elk type atoom: Het gebruikt subscripts na elk elementsymbool om het aantal atomen van dat element in het molecuul aan te geven. H₂o geeft bijvoorbeeld twee waterstofatomen en één zuurstofatoom aan.
* Het totale aantal atomen in het molecuul: U kunt dit berekenen door de subscripts voor alle elementen op te tellen.
Een moleculaire formule biedt echter niet de volgende informatie:
* De opstelling van atomen (structuur): Het vertelt je niet hoe de atomen met elkaar in het molecuul zijn verbonden.
* De vorm van het molecuul: Het duidt niet op de driedimensionale vorm van het molecuul.
* De aanwezige soorten obligaties: Het vertelt u niet of de obligaties enkele, dubbele of drievoudige bindingen zijn.
Voor deze aanvullende informatie zou u een structurele formule of een meer gedetailleerde weergave nodig hebben, zoals een Lewis -structuur.
Voorbeelden:
* h₂o (water): Deze formule vertelt ons dat water twee waterstofatomen en één zuurstofatoom bevat.
* c₆h₁₂o₆ (glucose): Deze formule geeft aan dat glucose zes koolstofatomen, twaalf waterstofatomen en zes zuurstofatomen heeft.
Over het algemeen geeft een moleculaire formule u een basiskennis van de samenstelling van een molecuul. Het is een startpunt voor het begrijpen van de eigenschappen van het molecuul, maar het biedt niet het volledige beeld.
 Nieuwe studie beschrijft hoe de chemische samenstelling van de Amerikaanse luchtvervuiling in de loop van de tijd is veranderd
Nieuwe studie beschrijft hoe de chemische samenstelling van de Amerikaanse luchtvervuiling in de loop van de tijd is veranderd  Nieuwe schaal voor elektronegativiteit herschrijft het leerboek scheikunde
Nieuwe schaal voor elektronegativiteit herschrijft het leerboek scheikunde Een rechterhand in een linkshandige want passen
Een rechterhand in een linkshandige want passen Superieure bio-inkt voor 3D-printen pionier
Superieure bio-inkt voor 3D-printen pionier Wat is Thermostat -polymeer?
Wat is Thermostat -polymeer?
Hoofdlijnen
- Bestaat het nucleaire membraan uit twee lagen?
- Als een bepaald operon codeert voor enzymen voor het maken van een essentieel aminozuur en wordt gereguleerd zoals de trp, zal het dan als corepressor fungeren?
- Waarom is het het beste voor wetenschapper om de naam van een organisme te gebruiken in plaats daarvan een gemeenschappelijke naam?
- Welk vet zoals substantie gevonden in elke cel die het lichaam van nature voorkomt?
- Bio-informatici schrappen een onnodige stap in eiwitstabiliteitsanalyse
- Studie vindt minder vogeldiversiteit in stadsbossen
- Klasactiviteiten op het ademhalingssysteem
- Wat is het Atacama-skelet en waarom is het zo controversieel?
- Wat gebeurt er op het chromosomale niveau als een resultaat van bevruchting?
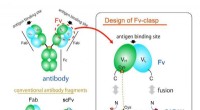
- Nieuw klein antilichaamfragment - een waardevol hulpmiddel bij kristallografie
- Onderzoekers herontdekken snelwerkend Duits insecticide dat verloren was gegaan in de nasleep van de Tweede Wereldoorlog

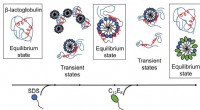
- Met zeep betrapt:begrijpen hoe zeepmoleculen eiwitten helpen om in en uit vorm te komen
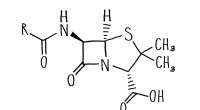
- Gerichte evolutie opent deur naar nieuwe antibiotica
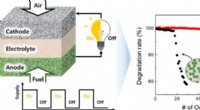
- Lager nikkelgehalte en verbeterde stabiliteit en prestaties in keramische brandstofcellen
 Is sucrose oplosbaar in natriumhydroxide?
Is sucrose oplosbaar in natriumhydroxide?  Onderzoeker vindt oude Pompeii-waterleidingen besmet met giftig antimoon
Onderzoeker vindt oude Pompeii-waterleidingen besmet met giftig antimoon Onderzoekers gebruiken AI om groene route naar nylon uit te stippelen
Onderzoekers gebruiken AI om groene route naar nylon uit te stippelen Hoeveel IE in een ml?
Hoeveel IE in een ml?  Er komen meer microplastics in de oceaan door wegwerpmaskers
Er komen meer microplastics in de oceaan door wegwerpmaskers Uit tests blijkt dat een draadloos netwerk GPS-systemen kan blokkeren
Uit tests blijkt dat een draadloos netwerk GPS-systemen kan blokkeren  Welk type binding wordt gevormd tussen jodium en koolstof?
Welk type binding wordt gevormd tussen jodium en koolstof?  Wat is een bryophyllum -plant in Hindi genoemd?
Wat is een bryophyllum -plant in Hindi genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

