
Wetenschap
Nieuw klein antilichaamfragment - een waardevol hulpmiddel bij kristallografie
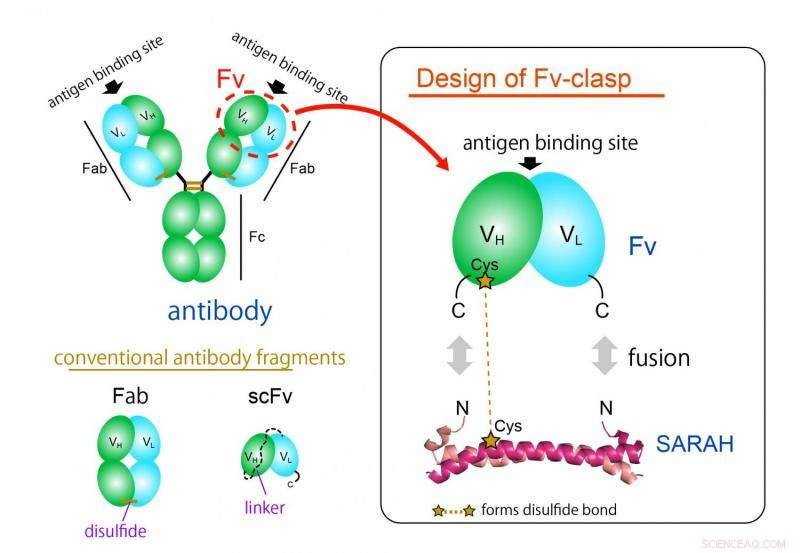
Figuur 1. Ontwerpconcept van een nieuw antilichaamfragmentformaat "Fv-clasp". Fv-clasp is een eenvoudige fusie van het SARAH-domein afgeleid van humaan Mst1-eiwit met het Fv (groen:zware keten, cyaan:lichte keten) fragment van een antilichaam. VH/VL-dimeer wordt gestabiliseerd door de dimeerconformatie van het SARAH-domein (donker en lichtmagenta). Krediet:Universiteit van Osaka
Antilichamen zijn een krachtig wapensysteem om ons lichaam te verdedigen tegen indringers zoals bacteriën en virussen. Elk antilichaam bestaat uit vier aminozuurpolypeptideketens:twee zware ketens en twee lichte ketens die zijn samengevoegd om een Y-vormig molecuul te vormen. Antilichamen herkennen een specifiek antigeen dat uniek is voor het doelwit, omdat ze de antigeenbindingsplaatsen hebben die zich aan de bovenste uiteinden van de Y bevinden. Hoewel op antilichaam gebaseerde therapieën zijn vastgesteld als eerstelijnsgeneesmiddelen, er is weinig vooruitgang geboekt in het gebruik van antilichamen als onderzoeksinstrumenten bij de ontdekking van geneesmiddelen in kleine moleculen, met name op het gebied van röntgenkristallografie.
Röntgenkristallografie is een techniek die röntgendiffractiepatronen gebruikt om hoge resolutie, driedimensionale structuren van moleculen zoals eiwitten, kleine organische moleculen, en materialen. De grootste uitdaging in de benaderingen van röntgenkristallografie blijft de productie van diffracterende kristallen van hoge kwaliteit.
In recente jaren, er is een toenemend gebruik van antilichaamfragmenten als kristallisatiebegeleiders om de structurele bepaling van anders "niet-kristalliseerbare" of "niet-geneesbare" doeleiwitten te helpen. De basis voor de strategie is om de kans op het verkrijgen van goed geordende kristallen te vergroten door de conformationele heterogeniteit in het doeleiwit te minimaliseren.
Het meest gebruikte antilichaamfragmentformaat is het Fab-formaat, maar het is moeilijk te produceren in bacteriële expressiesystemen vanwege de grote en complexe structuur. Het Fv-fragment van het antilichaam, die slechts één zware en één lichte keten bevat, zou ideaal zijn voor deze toepassing dankzij de eenvoudige en kleine architectuur. Echter, Fv wordt zelden gebruikt omdat de twee ketens gemakkelijk dissociëren, wat leidt tot functieverlies.

Figuur 2. Kristalstructuur van Fv-sluiting. Werkelijke driedimensionale structuur van Fv-sluiting bepaald door röntgenkristallografische analyse. Krediet:Universiteit van Osaka
Nutsvoorzieningen, een team van onderzoekers van de Universiteit van Osaka heeft een nieuw Fv-fragment met één keten ontworpen met verbeterde productiecompatibiliteit, stabiliteit en kristalliseerbaarheid, terwijl het bindingsvermogen van het oorspronkelijke molecuul behouden blijft. Ze publiceerden onlangs hun bevindingen in Structure.
"We hebben met succes een nieuw fragment geproduceerd door een anti-parallelle coiled-coil-structuur te fuseren die is afgeleid van een bepaald domein van een menselijk enzym, Mst1-kinase, aan de antigeenbindingsplaatsen van een antilichaam, " studie hoofdauteur Takao Arimori legt uit. "Het resulterende chimere molecuul, Fv-sluiting, was functioneel en structureel equivalent aan de Fv van het oorspronkelijke antilichaam."
Opmerkelijk, het overschakelen van Fab- naar Fv-clasp-formaat verbeterde aanzienlijk de door antilichamen ondersteunde kristallisatie van twee biologisch belangrijke eiwitten, de extracellulaire domeinen integrine a6b1 en sorLasorLA. Integrine a6b1 speelt een belangrijke rol bij de hechting van iPS-cellen en ES-cellen, evenals veel leverkankercellen aan het basaalmembraan, een extracellulair eiwitnetwerk dat aanwezig is in weefsels in de meeste cellen en organen, terwijl sorLA een eiwitreceptor is die betrokken is bij de ziekte van Alzheimer.
"De universele toepasbaarheid van het Fv-clasp-ontwerp voor grootschalige en goedkope productie maakt het wenselijk voor industriële toepassingen. Bovendien, de hoge hittestabiliteit is een groot voordeel voor immuuntherapieën, " zegt corresponderende auteur Junichi Takagi. "Afgezien van het gebied van structurele biologie, we verwachten dat het ontwerp van de Fv-sluiting zal bijdragen aan de uitbreiding van het reeds eminente gebruik van antilichamen in zowel basis- als toegepaste wetenschappen."
 Bewaar ambachtelijk bier op een koele plaats en consumeer het zo vers mogelijk
Bewaar ambachtelijk bier op een koele plaats en consumeer het zo vers mogelijk Wat is de chemische samenstelling van peninkt?
Wat is de chemische samenstelling van peninkt?  Duurzame optische vezels ontwikkeld uit methylcellulose
Duurzame optische vezels ontwikkeld uit methylcellulose Onderzoekers ontwikkelden sorteertechnologie op één celniveau met behulp van geluidsgolven
Onderzoekers ontwikkelden sorteertechnologie op één celniveau met behulp van geluidsgolven Chemici ontwikkelen verschillende industrieel belangrijke synthetische processen
Chemici ontwikkelen verschillende industrieel belangrijke synthetische processen
 De intensiteit van bosbranden heeft invloed op de waterkwaliteit en de behandeling ervan in beboste stroomgebieden
De intensiteit van bosbranden heeft invloed op de waterkwaliteit en de behandeling ervan in beboste stroomgebieden Evolutie na inslag van asteroïde Chicxulub:snelle reactie van leven op eind-krijtmassa
Evolutie na inslag van asteroïde Chicxulub:snelle reactie van leven op eind-krijtmassa Hightech-kaarten van de diversiteit van tropische bossen identificeren nieuwe doelen voor natuurbehoud
Hightech-kaarten van de diversiteit van tropische bossen identificeren nieuwe doelen voor natuurbehoud Satelliet vangt nachtelijke opname van grote orkaan Teddy
Satelliet vangt nachtelijke opname van grote orkaan Teddy Nieuwe tool verwijdert chemotherapiemedicijnen uit watersystemen
Nieuwe tool verwijdert chemotherapiemedicijnen uit watersystemen
Hoofdlijnen
- Stijgende temperaturen veranderen grote populatie zeeschildpadden vrouw
- Feiten over osmose voor kinderen
- Welke moleculen kunnen er zonder hulp door het plasmamembraan passeren?
- Stadia van ecologische successie
- Wetenschappers hebben ontdekt welke genen onkambaar haarsyndroom veroorzaken
- Planten evolueren geuren en kleuren om dieren aan te trekken voor zaadverspreiding
- Exotische dieren en de jacht op goud
- Wat is de schijfachtige structuur aan de zijde van chloroplasten?
- De effecten van algen in drinkwater
- Periodiek systeem:nieuwe versie waarschuwt voor elementen die in gevaar zijn
- Door spanning toe te voegen, onderzoekers verbeteren metaalglas

- Aceton plus licht creëert een groen additief voor vliegtuigbrandstof

- Spelveranderende bevinding duwt 3D-printen naar de moleculaire limiet

- Nieuwe techniek kan medicijnontwerp stroomlijnen

 Computergebaseerde weersvoorspelling:nieuw algoritme presteert beter dan mainframecomputersystemen
Computergebaseerde weersvoorspelling:nieuw algoritme presteert beter dan mainframecomputersystemen Doorbraak in genetisch onderzoek om gerstproductie te stimuleren
Doorbraak in genetisch onderzoek om gerstproductie te stimuleren Betere weersvoorspelling door assimilatie van satellietisotoopgegevens
Betere weersvoorspelling door assimilatie van satellietisotoopgegevens Transparante nabij-infrarood lichtgevende diodes
Transparante nabij-infrarood lichtgevende diodes Nieuw gebruik voor een oude onruststoker
Nieuw gebruik voor een oude onruststoker Groenlandse ijskap dreigt onomkeerbaar te smelten
Groenlandse ijskap dreigt onomkeerbaar te smelten Balkan met zeer hoge luchtvervuiling
Balkan met zeer hoge luchtvervuiling Daklozen krijgen geen basisgezondheidszorg, onderzoek vindt
Daklozen krijgen geen basisgezondheidszorg, onderzoek vindt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

