
Wetenschap
Een rechterhand in een linkshandige want passen
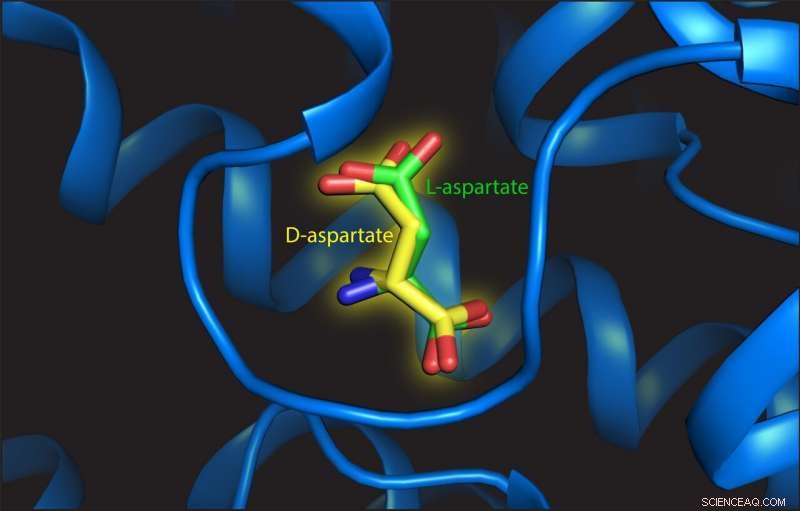
Deze afbeelding toont L- en D-aspartaat op de bindingsplaats van het transporteiwit. Krediet:Valentina Arkhipova, Rijksuniversiteit Groningen
Veel biomoleculen zijn er in twee versies die elkaars spiegelbeeld zijn, zoals een linker- en een rechterhand. Cellen gebruiken over het algemeen de linkerversie van aminozuren om eiwitten te produceren, en opnamemechanismen werden verondersteld deze voorkeur te delen. Wetenschappers van de Rijksuniversiteit Groningen hebben nu aangetoond dat een prokaryotisch transporteiwit beide versies van het aminozuur aspartaat even efficiënt kan transporteren. Gedetailleerde analyse van de structuur van de transporteur laat zien waarom dit het geval is. De resultaten zijn gepubliceerd in het tijdschrift eLife op 24 april.
De 'handigheid' van het leven is al meer dan een eeuw bekend. Veel organische moleculen worden geproduceerd in twee versies die dezelfde chemische formule en connectiviteit tussen de atomen hebben, maar structureel elkaars spiegelbeeld zijn. Tijdens de evolutie, voor sommige moleculen is gekozen voor de linkshandige versie (L), terwijl voor anderen het spiegelbeeld (D) wordt gebruikt. Dit is een probleem bij de productie van medicijnen, waarbij soms slechts één versie effectief is en de andere versie ernstige bijwerkingen kan veroorzaken.
Tegen de verwachtingen in
"Levende organismen gebruiken L-aminozuren bij de aanmaak van eiwitten, maar ze zullen af en toe D-aminozuren gebruiken, bijvoorbeeld in bacteriële celwanden, ", legt RUG-hoogleraar biochemie Dirk Slotboom uit. Het centrale zenuwstelsel van zoogdieren heeft een transporteiwit voor de neurotransmitter L-glutamaat dat ook het aminozuur aspartaat kan transporteren. "En dit blijkt zowel L-aspartaat als D- te herkennen." aspartaat."
Dit gaat tegen de verwachtingen in. Aangezien L-aminozuren de functioneel actieve verbindingen zijn, het zou logisch zijn voor transporteiwitten om slechts één "hand" te selecteren. Slotboom:"Dat volgt uit het verschil in structuur. Herkenning door een transporter vereist dat de structuur van het molecuul in de bindingsplaats past." En net zoals het niet mogelijk is om je linkerhand in een rechtshandige handschoen te passen, de binding van D-aminozuren aan een transporteiwit dat is geëvolueerd om L-aminozuren te accepteren, is onmogelijk.
Affiniteit
Er zijn tot nu toe geen echte mechanistische of structurele studies uitgevoerd om te verklaren waarom de transporter van het centrale zenuwstelsel deze logica lijkt te tarten. Daarom Slotboom, samen met zijn collega Albert Guskov, Universitair docent en hoofd van het Biomoleculaire X-ray Crystallography Lab, besloten om deze vraag aan te pakken. Hun postdoc-onderzoeker Valentina Arkhipova voerde een structurele analyse uit van het transporteiwit, terwijl Ph.D. student Gianluca Trinco voerde functionele studies uit. Voor hun experimenten, ze gebruikten het homologe transporteiwit dat in micro-organismen wordt gevonden, die een bindingsplaats heeft die bijna identiek is aan die van de zoogdiertransporteur.
Trinco ontdekte dat L-aspartaat en D-aspartaat op dezelfde manier werden vervoerd, aangedreven door de translocatie van drie natriumionen. "In aanvulling, de affiniteit voor beide substraten is ook vergelijkbaar, " zegt hij. Arkhipova bestudeerde de structuur van de bindingsplaats met L- of D-aspartaat eraan vastgemaakt. Ze merkte op dat D-aspartaat werd ondergebracht met slechts kleine herschikkingen van de structuur:"De sleutel is dat er voldoende ruimte is voor de geometrisch verschillende D-aspartaat te binden. De bindingsplaats is niet als een handschoen, maar meer als een want."
Neurotransmitter
Bij micro-organismen, het eiwit transporteert alleen aspartaat, die cellen zouden kunnen gebruiken om eiwitten te bouwen en ook als brandstof of als bron van stikstof kunnen gebruiken. Bij zoogdieren, het homologe eiwit transporteert glutamaat in het centrale zenuwstelsel, waarbij het aminozuur als neurotransmitter wordt gebruikt. Het transporteiwit verwijdert L-glutamaat uit de synapsspleet, het deel waar een zenuwimpuls wordt doorgegeven aan een ander neuron.
Er zijn aanwijzingen dat aspartaat ook als neurotransmitter kan werken. "Als dat zo zou zijn, zowel L- als D-aspartaat kunnen deze functie vervullen, ", zegt Slotboom. "De affiniteit voor beide soorten aspartaat is erg groot. Dit kan wijzen op een specifieke functie en suggereert dat D-aspartaat ook ergens voor wordt gebruikt." D-glutamaat wordt niet geaccepteerd door de vervoerder. Opnieuw, dit blijkt een kwestie van ruimte te zijn:glutamaat heeft een extra methyleengroep in vergelijking met aspartaat. "En in D-glutamaat, dat methyleen waarschijnlijk een botsing veroorzaakt met de bindingsplaats." Het past niet, niet eens in een want.
 Bouwstenen van DNA en RNA hadden samen kunnen verschijnen voordat het leven op aarde begon
Bouwstenen van DNA en RNA hadden samen kunnen verschijnen voordat het leven op aarde begon Het temmen van defecte poreuze materialen voor robuuste en selectieve heterogene katalyse
Het temmen van defecte poreuze materialen voor robuuste en selectieve heterogene katalyse Film-fotosensitizer:zeer efficiënte singlet-zuurstofgeneratie
Film-fotosensitizer:zeer efficiënte singlet-zuurstofgeneratie Overgangsmetalen en hun gebruik
Overgangsmetalen en hun gebruik Ontdekking van hoe amyloïden metaalionen binden werpt licht op de eiwitfunctie
Ontdekking van hoe amyloïden metaalionen binden werpt licht op de eiwitfunctie
 Onderzoekers onderzoeken hoe Antarctische ijskappen zullen reageren op klimaatverandering en wereldwijde zeespiegelstijging
Onderzoekers onderzoeken hoe Antarctische ijskappen zullen reageren op klimaatverandering en wereldwijde zeespiegelstijging Wat is het verschil tussen een sporen- en een stuifmeelkorrel?
Wat is het verschil tussen een sporen- en een stuifmeelkorrel?  NASA's weids uitzicht op grote orkaan Humbertos massieve Atlantische staart
NASA's weids uitzicht op grote orkaan Humbertos massieve Atlantische staart Dodelijke zomer van extreem weer
Dodelijke zomer van extreem weer India moet de infrastructuurbehoeften heroverwegen om 100 nieuwe slimme steden duurzaam te maken
India moet de infrastructuurbehoeften heroverwegen om 100 nieuwe slimme steden duurzaam te maken
Hoofdlijnen
- Genetische mutatie verklaart de oorsprong van sommige menselijke organen
- Japanse wetenschappers kweken medicijnen in kippeneieren
- Wat is het verschil tussen een bacteriële en virale infectie?
- Welke drie dingen helpen bloed door aderen te duwen?
- Mitosis: definitie, stadia en doel
- Ecosysteem: definitie, types, structuur en voorbeelden
- Het voordeel testen van linkshandig zijn in de sport
- Maak kennis met Cheddar Man:Your New Stone Age Crush
- Het simuleren van seks met walvisachtigen met kadaverdelen biedt inzicht in mariene copulatie
- Eiwit afgeleid van haver is in nieuwe techniek gekoppeld aan celzelfmoord-enzym

- Ethanolextractie SERS-strategie biedt zeer gevoelige detectie van vergiften in olieachtige matrix
- Van schuim tot bot:Plantaardige cellulose kan de weg vrijmaken voor gezonde botimplantaten

- Afstemming van de elektrokatalytische prestaties van bifunctionele katalysatoren
- Zeldzaam glasachtig metaal ontdekt tijdens zoektocht om batterijprestaties te verbeteren

 Als je pesten op scholen wilt tegengaan, kijk naar het onzichtbare geweld in onze samenleving
Als je pesten op scholen wilt tegengaan, kijk naar het onzichtbare geweld in onze samenleving Katalysatorvooruitgang kan leiden tot zuinige brandstofcellen
Katalysatorvooruitgang kan leiden tot zuinige brandstofcellen Hoe u een mRNA-reeks kunt berekenen
Hoe u een mRNA-reeks kunt berekenen Private equity-onderneming koopt Canadese WestJet-luchtvaartmaatschappij
Private equity-onderneming koopt Canadese WestJet-luchtvaartmaatschappij Feiten over de regenwoudenlagen
Feiten over de regenwoudenlagen Het begin van het einde van de orde:experimenten bewijzen Mermin-Wagner-fluctuaties
Het begin van het einde van de orde:experimenten bewijzen Mermin-Wagner-fluctuaties Trage Covid-vaccinatie kost de wereldeconomie $ 2,3 tn:studie
Trage Covid-vaccinatie kost de wereldeconomie $ 2,3 tn:studie VS zeggen dat Chinese leger massa's Amerikaanse gegevens heeft gestolen
VS zeggen dat Chinese leger massa's Amerikaanse gegevens heeft gestolen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

