
Wetenschap
Wat is de bindingshoek van CF2H2?
Dit is waarom:
* Hybridisatie: Het koolstofatoom in CF2H2 ondergaat SP3 -hybridisatie. Dit betekent dat het vier hybride orbitalen vormt die in een tetraëdrische vorm zijn gerangschikt.
* afstoting: De vier elektronenparen rond het koolstofatoom (twee C-F-bindingen, twee C-H-bindingen) stoten elkaar af om de afstand te maximaliseren en energie te minimaliseren.
* Ideale hoek: In een ideale tetraëdrische geometrie is de bindingshoek 109,5 graden.
De werkelijke bindingshoek in CF2H2 kan echter iets minder zijn dan 109,5 graden. Dit komt omdat de fluoratomen elektronegatiefer zijn dan waterstofatomen. Dit leidt tot een lichte toename van de elektronendichtheid rond de fluoratomen, waardoor een grotere afstoting tussen de C-F-bindingen en een iets kleinere bindingshoek veroorzaakt.
Samenvattend: De bindingshoeken in CF2H2 zijn bijna 109,5 graden, maar iets minder vanwege de elektronegativiteit van fluor.
 Wetenschappers gebruiken micro-organismen om functionele bacteriële cellulose in situ te fabriceren
Wetenschappers gebruiken micro-organismen om functionele bacteriële cellulose in situ te fabriceren Wanneer ammoniumcarbonaat ontleedt, wat zou er gebeuren met een gloeiende spalk in aanwezigheid van gassen die worden ontwikkeld?
Wanneer ammoniumcarbonaat ontleedt, wat zou er gebeuren met een gloeiende spalk in aanwezigheid van gassen die worden ontwikkeld?  Wat definieert een exotgeïsche reactie?
Wat definieert een exotgeïsche reactie?  Welk proces vindt plaats wanneer uranium -235 zich splitst in twee kleinere kernen plus neutronen?
Welk proces vindt plaats wanneer uranium -235 zich splitst in twee kleinere kernen plus neutronen?  Hoppig bier zonder ontploffende flessen en te veel alcohol
Hoppig bier zonder ontploffende flessen en te veel alcohol
 Britse wijnbouwgebieden om champagne te evenaren onthuld
Britse wijnbouwgebieden om champagne te evenaren onthuld wat- Alle planten krijgen energie van de zon. wortels hebben. Is deze bewering waar of niet waar? Ik kan concluderen dat alles met wortels zon krijgt.?
wat- Alle planten krijgen energie van de zon. wortels hebben. Is deze bewering waar of niet waar? Ik kan concluderen dat alles met wortels zon krijgt.?  Hoe divers zijn Amerikaanse oceaanwetenschappelijke instellingen?
Hoe divers zijn Amerikaanse oceaanwetenschappelijke instellingen?  Vertraagde opmars van noordpoolijs teruggevoerd op atmosferische omstandigheden in de buurt van Alaska maanden eerder
Vertraagde opmars van noordpoolijs teruggevoerd op atmosferische omstandigheden in de buurt van Alaska maanden eerder Noord-Atlantische Oceaan wordt minder zout, maar het is te vroeg om klimaatverandering de schuld te geven
Noord-Atlantische Oceaan wordt minder zout, maar het is te vroeg om klimaatverandering de schuld te geven
Hoofdlijnen
- Waarom zebravissen (bijna) altijd strepen hebben
- Onderzoekers ontdekken een nieuwe manier waarop ziekten evolueren
- Niet alle kroontjeskruid is gelijk voor eierleggende monarchen, studie onthult
- Welke celstructuur is belangrijk bij homeostase?
- Hoe werken Mexicaanse springbonen?
- Plasticity Cell Definition
- Wat is wetenschapper die de basis vormt voor hun onderzoek?
- Welke chemische stof die door sommige bacteriën wordt geproduceerd, kan de groei van andere bacteriën beperken?
- Wie ontdekte dat transformatie van DNA was?
- Onderzoekers ontwikkelen optische sensor die zeer lage glucoseconcentraties detecteert

- Elementair boor is een effectieve fotothermokatalysator voor de omzetting van kooldioxide
- Een nieuwe klasse membranen belooft interessante toepassingen in materiaalscheiding

- Onderzoekers creëren vloeistofafstotende substantie die op alle oppervlakken werkt

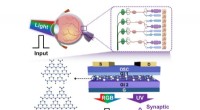
- Op het netvlies geïnspireerde fotonische synapsen op basis van koolstofnitride voor selectieve detectie van UV-licht
 Wat is het verschil tussen oceanische korst en continentaal Hoe beïnvloedt dit de interacties van de plaatgrens?
Wat is het verschil tussen oceanische korst en continentaal Hoe beïnvloedt dit de interacties van de plaatgrens?  Heeft stearinezuur een hoog smeltpunt?
Heeft stearinezuur een hoog smeltpunt?  Van colablikjes tot schoenenmenu's:wat zit er achter de opkomst van gepersonaliseerde producten?
Van colablikjes tot schoenenmenu's:wat zit er achter de opkomst van gepersonaliseerde producten?  Als een objecten snelheid wordt verdubbeld, wat gebeurt er met de traagheid?
Als een objecten snelheid wordt verdubbeld, wat gebeurt er met de traagheid?  Welk land bevindt zich 55 graden noord en 100 west?
Welk land bevindt zich 55 graden noord en 100 west?  Signalen van binnenuit de aarde:Borexino-experiment geeft nieuwe gegevens over geoneutrino's vrij
Signalen van binnenuit de aarde:Borexino-experiment geeft nieuwe gegevens over geoneutrino's vrij Designer polymeren op aanvraag
Designer polymeren op aanvraag Dieren en planten in de regio's Georgia
Dieren en planten in de regio's Georgia
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

