
Wetenschap
Waarom heeft Octane een hoger kookpunt dan water?
* waterstofbinding: Watermoleculen zijn ongelooflijk polair vanwege de sterke elektronegativiteit van zuurstof. Hierdoor kunnen ze sterke waterstofbruggen met elkaar vormen. Deze waterstofbruggen zijn zeer sterke intermoleculaire krachten, die een aanzienlijke hoeveelheid energie vereisen om te breken, wat leidt tot een hoog kookpunt (100 ° C).
* van der Waals krachten: Octaan, een niet -polair molecuul, ervaart alleen zwakkere dispersiekrachten in Londen (een type van der Waals Force). Deze krachten zijn veel zwakker dan waterstofbruggen, wat leidt tot een lager kookpunt voor octaan (-0,5 ° C).
Samenvattend:
* Water: Sterke waterstofbruggen =hoog kookpunt
* octaan: Zwakke London Dispersion Forces =Low Boiling Point
Laat het me weten als je nog meer vragen hebt over kookpunten of intermoleculaire krachten!
 Zeolietkatalysatoren effenen de weg naar decentrale chemische processen
Zeolietkatalysatoren effenen de weg naar decentrale chemische processen Wat heeft atomaire massa te maken met de lading van een atoom?
Wat heeft atomaire massa te maken met de lading van een atoom?  Is het niet reageren op een fysische of chemische stof?
Is het niet reageren op een fysische of chemische stof?  Het zelfaangepaste reactiepad maakt efficiënte oxidatie van aromatische C-H-bindingen via Co@Y-katalysator mogelijk
Het zelfaangepaste reactiepad maakt efficiënte oxidatie van aromatische C-H-bindingen via Co@Y-katalysator mogelijk  Welk element is een dofgrijs metaal?
Welk element is een dofgrijs metaal?
 Brandstichters Portugal voeden natuurbrandvernietiging
Brandstichters Portugal voeden natuurbrandvernietiging Bestaan er subtiele gewichtsverschillen op verschillende locaties op aarde?
Bestaan er subtiele gewichtsverschillen op verschillende locaties op aarde?  5 invasieve soorten die de wereld kunnen veroveren
5 invasieve soorten die de wereld kunnen veroveren  Waarom groeien maggots op vlees?
Waarom groeien maggots op vlees?  Eiken in plaats van palmbomen? De iconische palmen van Florida kunnen het niet redden met de klimaatverandering
Eiken in plaats van palmbomen? De iconische palmen van Florida kunnen het niet redden met de klimaatverandering
Hoofdlijnen
- Hoe maak je een RNA & een DNA-model
- Onderzoekers onthullen een verborgen eigenschap in de genomen van Mycobacterium die de aanpassing aan stress regelt
- Getoonde chimpansees die spontaan om de beurt een cijferpuzzel oplossen
- Wat zijn 3 onderscheidende kenmerken van Euglenophytes?
- Genetici ontdekken twee verschillende manieren om transcriptie te beëindigen
- Wat doet een bladcel?
- Lood visgerei kan een bedreiging vormen voor de populaties van duikers
- Hoe het boren naar olie in het Arctic National Wildlife Refuge van invloed kan zijn op dieren in het wild
- Hoe heet een individuele luchtcel?
- Ontwikkeld enzym dat PET in tien uur kan afbreken
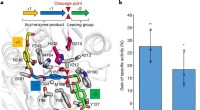
- Materiaal gemaakt van een enkel molecuul vormt zichzelf tot een rooster dat zichzelf kan genezen, gassen opslaan
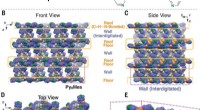
- Alternatief proces voor het omzetten van witte fosfor belooft meer duurzaamheid in de chemische industrie

- De strijd tegen tandbederf krijgt hulp met een nieuw slim materiaal

- Onderzoekers ontwikkelen materialen om geneesmiddelen uit afvalwater te verwijderen
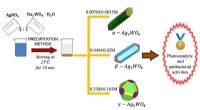
 De coronale sluier:zijn de magnetische bogen van de zon een optische illusie?
De coronale sluier:zijn de magnetische bogen van de zon een optische illusie? Onderzoekers ontdekken kosmische stofstormen van Type 1a supernova
Onderzoekers ontdekken kosmische stofstormen van Type 1a supernova  Is CaSO4 ionisch of covalent gebonden?
Is CaSO4 ionisch of covalent gebonden?  Wetenschappers ontwikkelen indoor-actieve fotokatalysator voor antivirale coating tegen verschillende COVID-varianten
Wetenschappers ontwikkelen indoor-actieve fotokatalysator voor antivirale coating tegen verschillende COVID-varianten Hoe zijn pulsars gerelateerd aan supernova's?
Hoe zijn pulsars gerelateerd aan supernova's?  Wie was de eerste man die in een baan om de maan draaide?
Wie was de eerste man die in een baan om de maan draaide?  Voor de bomen van Madrid, record sneeuwval laat diepe wonden achter
Voor de bomen van Madrid, record sneeuwval laat diepe wonden achter Duurzaamheid belangrijk voor internationale toeristen - nieuw onderzoek
Duurzaamheid belangrijk voor internationale toeristen - nieuw onderzoek
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

