
Wetenschap
Waarom bevriest zoutwater onder 0 Celsius?
* Freezing Point Depression: Wanneer u zout (NaCl) in water oplost, verstoren de zoutionen (Na+ en Cl-) de vorming van de normale, kristallijne structuur die zuiver water vormt wanneer deze bevriest. De watermoleculen moeten verder uit elkaar zijn om de zoutionen te huisvesten, die een lagere temperatuur vereisen om te stollen.
* Colligatieve eigenschap: Bevriezende puntdepressie is een colligatieve eigenschap, wat betekent dat het afhankelijk is van het aantal opgeloste deeltjes in een oplossing, niet op het specifieke type opgeloste stof. Dus elke opgeloste stof verlaagt het vriespunt van water tot op zekere hoogte.
* zoutgehalte: Hoe meer zout opgelost in het water, hoe lager het vriespunt. Oceaanwater, met een gemiddeld zoutgehalte van ongeveer 3,5%, bevriest op ongeveer -1,9 graden Celsius (-2,8 graden Fahrenheit).
Samenvattend: De aanwezigheid van zoutionen in water verstoort de vorming van ijskristallen, waardoor een lagere temperatuur nodig is om de oplossing te stollen.
 Welke anorganische moleculen vormen glucose?
Welke anorganische moleculen vormen glucose?  Wat zijn de Lewis -structuren van CH2?
Wat zijn de Lewis -structuren van CH2?  Hoeveel mol PCL5 kan worden geproduceerd uit 58,0 g CL2 (en overtollig P4)?
Hoeveel mol PCL5 kan worden geproduceerd uit 58,0 g CL2 (en overtollig P4)?  Welk deel van een atoom bestaat niet uit een quark?
Welk deel van een atoom bestaat niet uit een quark?  Nieuwe technologie biedt opwindende inzichten in hoe katalysatoren op atomair niveau werken
Nieuwe technologie biedt opwindende inzichten in hoe katalysatoren op atomair niveau werken
 Bodemwetenschappers verhogen het fosforgehalte in padiebodems
Bodemwetenschappers verhogen het fosforgehalte in padiebodems Potentiële tropische cycloon 2 in de Atlantische Oceaan onderzocht door NASA
Potentiële tropische cycloon 2 in de Atlantische Oceaan onderzocht door NASA Veengebieden stoten meer methaan uit bij verstoring door wegen
Veengebieden stoten meer methaan uit bij verstoring door wegen De showlooks van mannetjeskoninkjes kunnen bedrieglijk zijn
De showlooks van mannetjeskoninkjes kunnen bedrieglijk zijn  Franse wijnmakers rekenen de kosten van de ergste vorst in decennia
Franse wijnmakers rekenen de kosten van de ergste vorst in decennia
Hoofdlijnen
- Wat is mond- en klauwzeer?
- Welke van de divisies vaatplanten heeft meer leden?
- Wanneer is de beste tijd van de dag om een beslissing te nemen?
- Dode walvis verrast zwemmers op iconisch strand van Rio
- Bevat Amylase zowel een alfa -helix als een bèta geplooide vellen?
- Wat gebeurt er met een pathogene schimmel die in de ruimte groeit?
- Wie is verantwoordelijk als een gevangene zelfmoord pleegt?
- Onderzoekers verkrijgen gegevens over de ontwikkeling van kippenembryo's
- Wat zijn de 3 meest voorkomende elementen in menselijke lichamen?
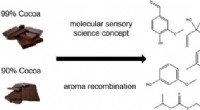
- De geur van pure chocolade, gedemystificeerd
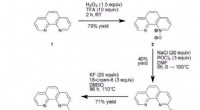
- Nieuwe methode voor het produceren van PET-radiotracers met hogere radiochemische opbrengsten
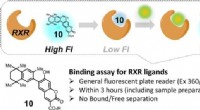
- Synthetische verbinding zorgt voor snelle screening op potentiële medicijnen
- Een thermometer die kan worden uitgerekt en vervormd door water
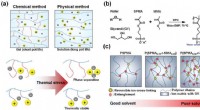
- Zacht maar sterk:biohybride materiaal presteert als kraakbeen
 De randstromen die niet met de stroom meegaan:wetenschappers doen merkwaardige kwantumontdekking
De randstromen die niet met de stroom meegaan:wetenschappers doen merkwaardige kwantumontdekking Wat is de classificatie van menselijke handelingen?
Wat is de classificatie van menselijke handelingen?  Ontdekking daagt geaccepteerde regel van organisch zonnecelontwerp uit
Ontdekking daagt geaccepteerde regel van organisch zonnecelontwerp uit Instructies voor kinderen over het gebruik van een microscoop
Instructies voor kinderen over het gebruik van een microscoop Wat zijn de belangrijkste componenten van een goed ontwikkeld bodemprofiel?
Wat zijn de belangrijkste componenten van een goed ontwikkeld bodemprofiel?  Onderzoekers creëren krachtveld voor supermaterialen
Onderzoekers creëren krachtveld voor supermaterialen Wie heeft Voyager 2 naar Neptunus gestuurd?
Wie heeft Voyager 2 naar Neptunus gestuurd?  Hoe wordt werk gerelateerd aan kracht en verplaatsing besproken in termen van basiseenheden?
Hoe wordt werk gerelateerd aan kracht en verplaatsing besproken in termen van basiseenheden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

