
Wetenschap
Wat beschrijft de definitie van atomaire massa het beste een element?
De gemiddelde massa van alle natuurlijk voorkomende isotopen van een element, uitgedrukt in atomaire massa -eenheden (AMU).
Dit is waarom:
* isotopen: Elementen kunnen verschillende vormen hebben die isotopen worden genoemd. Isotopen van hetzelfde element hebben hetzelfde aantal protonen maar verschillende aantallen neutronen. Dit betekent dat ze iets verschillende massa's hebben.
* Gemiddelde massa: Atomische massa is het gewogen gemiddelde van de massa van alle isotopen van dat element, rekening houdend met hun relatieve overvloed in de natuur.
* Atomic Mass -eenheden (AMU): Atomische massa wordt uitgedrukt in atomaire massa -eenheden (AMU). Eén AMU wordt gedefinieerd als 1/12e de massa van een koolstof-12-atoom.
Voorbeeld: Koolstof heeft twee hoofdisotopen:koolstof-12 en koolstof-13. Carbon-12 is veel overvloediger, dus de atoommassa van koolstof is dichter bij 12 AMU dan 13 AMU.
 Zwevend in de zomer met meer drijfvermogen, vloeistofdichte reddingsvesten en zwemkleding
Zwevend in de zomer met meer drijfvermogen, vloeistofdichte reddingsvesten en zwemkleding Wat is universeel pH-papier?
Wat is universeel pH-papier?  Slimmer verwarmen, niet moeilijker:hoe microgolven katalytische reacties efficiënter maken
Slimmer verwarmen, niet moeilijker:hoe microgolven katalytische reacties efficiënter maken Analytische methoden helpen bij het ontwikkelen van tegengiffen voor cyanide, mosterdgas
Analytische methoden helpen bij het ontwikkelen van tegengiffen voor cyanide, mosterdgas Hoe schrijf je de chemische formules van verbindingen met polyatomaire ionen?
Hoe schrijf je de chemische formules van verbindingen met polyatomaire ionen?
 Dierlijke productie verantwoordelijk voor het overgrote deel van de luchtkwaliteitsgerelateerde gezondheidseffecten van Amerikaans voedsel
Dierlijke productie verantwoordelijk voor het overgrote deel van de luchtkwaliteitsgerelateerde gezondheidseffecten van Amerikaans voedsel Het project wil leren hoe superpaddenstoelen groeien, met termieten als leraren
Het project wil leren hoe superpaddenstoelen groeien, met termieten als leraren  Microplastics in de oceaan:eerste wereldbeeld toont seizoensveranderingen en bronnen
Microplastics in de oceaan:eerste wereldbeeld toont seizoensveranderingen en bronnen NASA vindt tropische storm Francisco in de Straat van Korea
NASA vindt tropische storm Francisco in de Straat van Korea Waarom heeft de wetenschap meer kwaad dan goed gedaan?
Waarom heeft de wetenschap meer kwaad dan goed gedaan?
Hoofdlijnen
- Komt de gemanipuleerde 'Frankenfish' naar de tafel van het land?
- spijt,
- Via welke methode vindt de ontwikkeling in meercellige organismen plaats?
- Onderzoekers ontrafelen de kristalstructuur van een belangrijk enzym van SARS-CoV-2, wat de weg vrijmaakt voor nieuwe antivirale middelen
- Wetenschappers vinden potentiële wapens voor de strijd tegen antibioticaresistentie
- Hoe komt bacteriën daar eten?
- Hoe hersendood werkt
- Hoe rouw werkt
- Wat zijn de verschillende rollen in het wetenschapsonderzoeksteam?
- Boswetenschappers ontwikkelen innovatieve materialen op houtbasis voor 3D-printen

- Forensisch chemicus stelt zweetteststrip voor als vervanging voor ademanalyse

- Bepaling van de kristalstructuur van een DNA-gestabiliseerd zilveren nanocluster
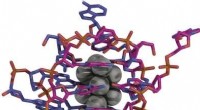
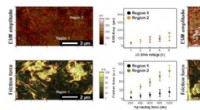
- Visualisatie van functionele componenten om optimale composietelektroden te karakteriseren
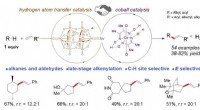
- Nieuwe methode voor functionalisering van koolstof-waterstofbindingen in een laat stadium
 Hoe relaties tussen biodiversiteit en productiviteit veranderen naarmate de hoogte in bossen toeneemt
Hoe relaties tussen biodiversiteit en productiviteit veranderen naarmate de hoogte in bossen toeneemt  Onderzoekers leggen de wetenschap en geschiedenis uit achter de overgang van oude booreilanden naar permanente riffen
Onderzoekers leggen de wetenschap en geschiedenis uit achter de overgang van oude booreilanden naar permanente riffen Gebruiken kerncentrales uranium om energie te produceren?
Gebruiken kerncentrales uranium om energie te produceren?  Waarom lossen aspro heldere tabletten op in water?
Waarom lossen aspro heldere tabletten op in water?  Verminderde vervuiling kan in 2040 een jaar aan het leven van Kopenhageners toevoegen
Verminderde vervuiling kan in 2040 een jaar aan het leven van Kopenhageners toevoegen Waarom zou besnijdenis het risico van een man om AIDS op te lopen verminderen?
Waarom zou besnijdenis het risico van een man om AIDS op te lopen verminderen?  Waarom worden haakjes gebruikt om de formule Al(OH)3 te schrijven?
Waarom worden haakjes gebruikt om de formule Al(OH)3 te schrijven?  Waarom migreren machtsparen naar grootstedelijke gebieden? Eigenlijk niet
Waarom migreren machtsparen naar grootstedelijke gebieden? Eigenlijk niet
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

