
Wetenschap
Wat is de normaliteit van een fosforzuur van 0,10 m oplossing?
Normaliteit begrijpen
* normaliteit (n) vertegenwoordigt het aantal equivalenten van een opgeloste oplossing.
* equivalenten zijn het aantal mol reactieve eenheden (zoals H+ ionen) in een oplossing.
fosforzuur (h₃po₄)
* Fosforzuur heeft drie zure protonen (H+ ionen) die kunnen worden vrijgegeven.
Berekening
1. Identificeer het aantal equivalenten: Omdat fosforzuur 3 zure protonen heeft, biedt elke mol H₃PO₄ 3 equivalenten van H+ -ionen.
2. Bereken de normaliteit:
* Normaliteit (n) =molariteit (m) x aantal equivalenten per mol
* N =0,10 m x 3
* n =0,30 n
Daarom heeft een 0,10 m oplossing van fosforzuur een normaliteit van 0,30 n.
 Welk type molecuul wordt hieronder weergegeven:ether, keton, alcohol, aldehyde?
Welk type molecuul wordt hieronder weergegeven:ether, keton, alcohol, aldehyde?  Atomen met acht valentie -elektronen vormen gemakkelijk verbindingen?
Atomen met acht valentie -elektronen vormen gemakkelijk verbindingen?  In welk deel van de auto wordt koper gebruikt?
In welk deel van de auto wordt koper gebruikt?  Krijgt of verliest Helium elektronen om verbindingen te vormen?
Krijgt of verliest Helium elektronen om verbindingen te vormen?  Het voorspellen van de kans op vissen in een regio met giftige niveaus van methylkwik
Het voorspellen van de kans op vissen in een regio met giftige niveaus van methylkwik
 Extreme eco-tent getest op Antarctica
Extreme eco-tent getest op Antarctica Nieuw onderzoek onthult extreme complexiteit bij de vorming van zeldzame aardmineralen die van vitaal belang zijn voor de technische industrie
Nieuw onderzoek onthult extreme complexiteit bij de vorming van zeldzame aardmineralen die van vitaal belang zijn voor de technische industrie  Lijst met neolithische gereedschappen voor steen
Lijst met neolithische gereedschappen voor steen  Deze twee dingen zijn belangrijk bij het herstellen van natuurrampen
Deze twee dingen zijn belangrijk bij het herstellen van natuurrampen Hoe beïnvloeden landvormen en wateren het klimaat?
Hoe beïnvloeden landvormen en wateren het klimaat?
Hoofdlijnen
- Hoe zijn lytische en lysogene cycli hetzelfde?
- Hoe bacteriën met zout te doden
- Uit onderzoek blijkt hoe twee stammen van één bacterie samen een vleesetende infectie veroorzaken
- Wat is de wetenschappelijke classificatie van ashwagandha?
- Hoe komt de zebravis aan zijn strepen? Onderzoekers zijn een stap dichter bij het vinden ervan
- Elandenpopulatie in Vermont worstelt ondanks bezuiniging op jacht
- Wat is een gecontroleerde experimentele groep in experiment en waarom het belangrijk is?
- Hoe empathie werkt
- Waarom zijn de mentale afbeeldingen die wetenschappers nuttig gebruiken?
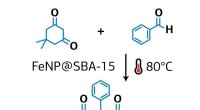
- Chemicus stelt nieuwe methode voor voor groene synthese van xantheenderivaten
- Goedkope detector is als klittenband voor kankercellen
- Wetenschappers bedenken diervrije testen van dodelijke neurotoxines

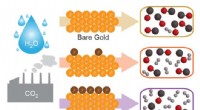
- Wetenschappers stemmen het systeem af om syngas te maken uit CO2
- Detectie van koolmonoxide in het lichaam kan leiden tot snelle diagnostiek van ziekten
 Enquête toont aan dat er meer moet worden gedaan aan diversiteit en inclusie op de werkplek
Enquête toont aan dat er meer moet worden gedaan aan diversiteit en inclusie op de werkplek Wat zijn smeltverbindingen?
Wat zijn smeltverbindingen?  Heeft de toegenomen genduplicatie de weg geëffend voor de menselijke evolutie?
Heeft de toegenomen genduplicatie de weg geëffend voor de menselijke evolutie?  Met welke factoren moeten rekening worden gehouden bij het kiezen van metalen of niet-metalen systemen?
Met welke factoren moeten rekening worden gehouden bij het kiezen van metalen of niet-metalen systemen?  In het bos van Alaska, Reagan-biograaf ziet een winnende GOP-strategie
In het bos van Alaska, Reagan-biograaf ziet een winnende GOP-strategie Samen werken aan het plasticprobleem:hoe houden we burgers betrokken?
Samen werken aan het plasticprobleem:hoe houden we burgers betrokken?  Wat is versterkt magnesium?
Wat is versterkt magnesium?  Lichtgevende quasar PDS 456 onderzocht met MUSE
Lichtgevende quasar PDS 456 onderzocht met MUSE
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

