
Wetenschap
Wat is de anode van galvanische cel gemaakt met zink en alumminum?
Galvanische cellen begrijpen
* Galvanische cellen: Dit zijn elektrochemische cellen die elektriciteit genereren door spontane redoxreacties.
* anode: De elektrode waar oxidatie optreedt (verlies van elektronen).
* kathode: De elektrode waar reductie optreedt (versterking van elektronen).
het bepalen van de anode
1. Identificeer het meer reactief metaal: Zink is reactiever dan aluminium. Dit betekent dat zink een grotere neiging heeft om elektronen te verliezen en te oxideren.
2. Pas de reactiviteitsreeks toe: De reactiviteitsreeks van metalen helpt voorspellen welk metaal zal oxideren (fungeert als de anode). Metalen hoger in de serie zijn reactiever.
3. Conclusie: Omdat zink meer reactief is dan aluminium, is dit de anode in de galvanische cel.
Reactiesamenvatting
In deze galvanische cel:
* anode (zink): Zn (s) → Zn²⁺ (aq) + 2e⁻ (oxidatie)
* kathode (aluminium): Al³⁺ (aq) + 3e⁻ → al (s) (reductie)
Sleutelpunt: De algemene reactie in de cel is de combinatie van deze twee halve reacties, waarbij elektronen van de zinkanode naar de aluminiumkathode door een extern circuit stromen.
 Is het mogelijk om hardheid van water te verwijderen door elektrolyse?
Is het mogelijk om hardheid van water te verwijderen door elektrolyse?  Bioengineered hybride spiervezel voor regeneratieve geneeskunde
Bioengineered hybride spiervezel voor regeneratieve geneeskunde Een olie met een of meer dubbele bindingen in het vetzuur?
Een olie met een of meer dubbele bindingen in het vetzuur?  Hoe T-vormige clusters de scheiding van lanthaniden bevorderen tijdens vloeistof-vloeistofextractie
Hoe T-vormige clusters de scheiding van lanthaniden bevorderen tijdens vloeistof-vloeistofextractie  Hoe superbacteriën spiegelbeelden gebruiken om antibioticaresistentie te creëren
Hoe superbacteriën spiegelbeelden gebruiken om antibioticaresistentie te creëren
 Weervoorspelling:hittegolven kunnen nu namen krijgen. De eerste is Zoe, in Spanje
Weervoorspelling:hittegolven kunnen nu namen krijgen. De eerste is Zoe, in Spanje Het Japanse Sapporo beleeft de eerste dag van 25 graden Celsius sinds het begin van de metingen
Het Japanse Sapporo beleeft de eerste dag van 25 graden Celsius sinds het begin van de metingen  Wetenschap Fair Hoe beïnvloedt geen zonlicht planten?
Wetenschap Fair Hoe beïnvloedt geen zonlicht planten?  Kernza:het milieuvriendelijke tarwegewas dat de wereld wil voeden
Kernza:het milieuvriendelijke tarwegewas dat de wereld wil voeden  De vooruitzichten van Amerikaanse aardbeien
De vooruitzichten van Amerikaanse aardbeien
Hoofdlijnen
- Alternatieve evolutie:waarom je eigen genen veranderen als je die van iemand anders kunt lenen?
- Hoe verdeelt het cytoplasma zich tussen dochtercellen na mitose?
- Waarom zou een cel veel rRNA maken, maar slechts één exemplaar van DNA?
- Waarom zijn sommige E. coli dodelijk terwijl andere vreedzaam in ons lichaam leven?
- Welke soort weefsel geeft de meeste tijd in interfase?
- Zijn akkoord met één cellen of meercellig?
- Wat zijn de functies van de linker en rechter Atria?
- Onderzoek toont aan dat seksueel parasitisme zeeduivel hielp de diepzee binnen te dringen in een tijd van opwarming van de aarde
- Zure druiven:Besschade, fruitvliegjes verergeren wijn
- Wanneer het veranderen van één atoom moleculen beter maakt

- Onderzoekers ontwikkelen nieuwe bijna-ultraviolette LED-prikkelbare nabij-infraroodstralers
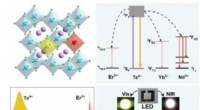
- Chemici zien een vluchtige overgangstoestand van een reactie

- Onderzoekers ontwikkelen een methode om miljoenen potentiële zelfgeproduceerde kandidaat-geneesmiddelen in één keer te onderzoeken

- Een doorbraak in onderzoek naar chirale polymere dunne films zou een nieuwe generatie apparaten mogelijk kunnen maken
 Hoe de hormonen van de hypofyse te onthouden
Hoe de hormonen van de hypofyse te onthouden  Zou een slechte millivolt-thermozuil ervoor zorgen dat de waakvlam in de vloeroven niet blijft branden?
Zou een slechte millivolt-thermozuil ervoor zorgen dat de waakvlam in de vloeroven niet blijft branden?  Studie van analoge bemanningen in isolatie onthult zwakke plekken voor Mission to Mars
Studie van analoge bemanningen in isolatie onthult zwakke plekken voor Mission to Mars Onderzoek heeft een proactieve benadering van de verdediging van computersystemen
Onderzoek heeft een proactieve benadering van de verdediging van computersystemen Wetenschappers maken gebruik van chemische dynamiek voor het oplossen van complexe problemen
Wetenschappers maken gebruik van chemische dynamiek voor het oplossen van complexe problemen  Welk type eigenschappen zijn fysisch of chemisch gemakkelijker te herkennen?
Welk type eigenschappen zijn fysisch of chemisch gemakkelijker te herkennen?  Van quarks tot kwartels:kunnen de verschillende wetenschappen worden verenigd?
Van quarks tot kwartels:kunnen de verschillende wetenschappen worden verenigd? Wat zijn de bouwstenen voor eiwitten?
Wat zijn de bouwstenen voor eiwitten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

