
Wetenschap
Wat is het verschil tussen atoomgewicht en massamolecuulgewicht van massa?
Atomisch gewicht
* Definitie: De gemiddelde massa van een atoom van een element, rekening houdend met de relatieve overvloed van zijn isotopen.
* eenheden: Atomische massa -eenheden (AMU) of gram per mol (g/mol)
* focus: Individuele atomen
* Voorbeeld: Het atoomgewicht van koolstof is 12.011 AMU. Dit komt omdat koolstof bestaat in twee hoofdisotopen:koolstof-12 (12 AMU) en koolstof-13 (13 AMU), waarbij koolstof-12 veel overvloediger is.
Massa molecuulgewicht
* Definitie: De massa van één mol van een molecuul. Het is de som van de atoomgewichten van alle atomen in een molecuul.
* eenheden: Gram per mol (g/mol)
* focus: Moleculen
* Voorbeeld: Het massamolecuulgewicht van water (H₂o) is 18,015 g/mol. Dit wordt berekend door de atoomgewichten van twee waterstofatomen (elk 1,008 AMU) toe te voegen en één zuurstofatoom (15.999 AMU).
Sleutelverschillen
1. Focus: Atomisch gewicht gaat over individuele atomen, terwijl massamolecuulgewicht zich richt op moleculen.
2. Berekening: Atoomgewicht is een gemiddelde gebaseerd op de overvloed aan isotoop, terwijl massamolecuulgewicht de som van atoomgewichten is.
3. eenheden: Beide kunnen worden uitgedrukt in gram per mol (g/mol), maar atoomgewicht wordt ook vaak uitgedrukt in atomaire massa -eenheden (AMU).
Samenvattend:
* Atoomgewicht is de gemiddelde massa van een atoom van een element.
* Massa -molecuulgewicht is de massa van één mol van een molecuul.
Laat het me weten als je nog meer vragen hebt!
 Waarom is kwik slecht in het delen van elektronen?
Waarom is kwik slecht in het delen van elektronen?  Welke intermoleculaire kracht zou het smeltpunt het minst beïnvloeden? Ionische bindingen Van der Waals forceert waterstofbruggen of dipool-dipoolinteracties?
Welke intermoleculaire kracht zou het smeltpunt het minst beïnvloeden? Ionische bindingen Van der Waals forceert waterstofbruggen of dipool-dipoolinteracties?  Poreuze polymeren vertonen opmerkelijke stabiliteit bij hoge druk
Poreuze polymeren vertonen opmerkelijke stabiliteit bij hoge druk welke twee atomen vormen een covalente binding?
welke twee atomen vormen een covalente binding?  Welke materialen zijn nodig voor fotosynthese?
Welke materialen zijn nodig voor fotosynthese?
 Wat zijn een primaire bron en secundaire bron?
Wat zijn een primaire bron en secundaire bron?  De wereld heeft een nieuwe manier van denken nodig om te overleven, zegt Goodall
De wereld heeft een nieuwe manier van denken nodig om te overleven, zegt Goodall Waarom is de wereld geweldig?
Waarom is de wereld geweldig?  Het deep learning-model voorspelt de ophoping van afval en bepaalt hoe vaak afval moet worden opgehaald
Het deep learning-model voorspelt de ophoping van afval en bepaalt hoe vaak afval moet worden opgehaald  Studenten brengen zestig jaar data tot leven op het web
Studenten brengen zestig jaar data tot leven op het web
Hoofdlijnen
- Gasachtige koeien zijn slecht voor de planeet; Kan een zeewierdieet helpen?
- Nieuwe aanwijzingen waarom mutaties in het MYH9-gen een breed spectrum aan aandoeningen bij mensen veroorzaken
- Hoe groeit schimmel op voedsel?
- Welke organismen maken beperkingsenzymen?
- Wil je de bijen redden? Let op ziekteverwekkers en bloemen
- Oude uitwerpselen onthullen hoe 'moerasdieet' de Vennen uit de Bronstijd met parasieten besmette
- Hoe oud is mijn huisdier in honden- of kattenjaren? Een dierenarts legt het uit
- Hoe E. coli de kracht krijgt om urineweginfecties te veroorzaken
- Hoe Spaced Repetition examen tijd een fluitje van een cent kan maken
- Onderzoekers ontsluiten een nieuwe methode voor het testen van op eiwit gebaseerde medicijnen
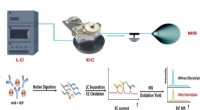
- Aroma's detecteren in oude cognac

- Studie onthult vormingsmechanisme van eerste koolstof-koolstofbinding in MTO-proces
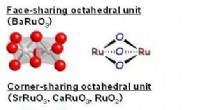
- Bariumruthenaat:een hoog rendement, gemakkelijk te hanteren perovskietkatalysator voor de oxidatie van sulfiden
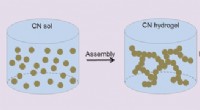
- Carbonitride-aerogels bemiddelen de fotokatalytische omzetting van water
 Hoe kun je orkanentornado's vergelijken en contrasteren met behulp van een Venn-diagram?
Hoe kun je orkanentornado's vergelijken en contrasteren met behulp van een Venn-diagram?  Zal een eierschaal oplossen in azijn?
Zal een eierschaal oplossen in azijn?  Aerogel:het microstructuurmateriaal van de toekomst
Aerogel:het microstructuurmateriaal van de toekomst Physics Egg-Drop Experiment Ideas
Physics Egg-Drop Experiment Ideas  Wetenschappers ontrafelen signaalversterking met ruis in systemen met geheugen
Wetenschappers ontrafelen signaalversterking met ruis in systemen met geheugen Studie:Hoewel het grootste deel van de wereld klimaatwetenschappers vertrouwt, kan een sceptische minderheid leiden tot klimaatinactiviteit
Studie:Hoewel het grootste deel van de wereld klimaatwetenschappers vertrouwt, kan een sceptische minderheid leiden tot klimaatinactiviteit  Lossen verschillende kleuren sneller op dan anderen?
Lossen verschillende kleuren sneller op dan anderen?  Mensen zijn niet van de haak voor het uitsterven van grote herbivoren - toen of nu
Mensen zijn niet van de haak voor het uitsterven van grote herbivoren - toen of nu
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

