
Wetenschap
Hoe is de wet van gespreksmassa van toepassing op chemische reacties?
1. Atomen worden herschikt, niet vernietigd:
- Chemische reacties omvatten het breken en vormen van chemische bindingen tussen atomen.
- De atomen zelf blijven ongewijzigd. Ze herschikken eenvoudigweg om nieuwe moleculen te vormen.
2. Totale massa blijft constant:
- De totale massa van de reactanten (uitgangsmaterialen) moet gelijk zijn aan de totale massa van de producten (gevormde stoffen).
- Dit komt omdat het aantal en soorten atomen die aanwezig zijn vóór de reactie gelijk moeten zijn aan het aantal en de soorten atomen die aanwezig zijn na de reactie.
3. Balancing chemische vergelijkingen:
- Chemische vergelijkingen vertegenwoordigen de symbolische weergave van chemische reacties.
- De wet van behoud van massa wordt gebruikt om ervoor te zorgen dat het aantal van elk type atoom aan de reactantzijde gelijk is aan het aantal van elk type atoom aan de productzijde. Dit proces wordt de vergelijking genoemd.
Voorbeeld:
De reactie van waterstofgas (H2) met zuurstofgas (O2) om water (H2O) te produceren:
2 H2 + O2 → 2 H2O
- Reactanten:4 waterstofatomen (2 x 2) en 2 zuurstofatomen (1 x 2).
- Producten:4 waterstofatomen (2 x 2) en 2 zuurstofatomen (1 x 2).
Zoals u kunt zien, is het aantal van elk type atoom hetzelfde aan beide zijden van de vergelijking, wat het behoud van massa aantoont.
Implicaties voor chemie:
* Productieopbrengsten: De wet van het behoud van massa helpt de hoeveelheid product te voorspellen die wordt verwacht van een bepaalde hoeveelheid reactanten.
* Stoichiometry begrijpen: Stoichiometrie, de studie van de kwantitatieve relaties tussen reactanten en producten, is sterk afhankelijk van het behoud van massa.
* Chemische processen ontwikkelen: Inzicht in hoe massa wordt geconserveerd in reacties is essentieel voor het ontwerpen en optimaliseren van chemische processen in verschillende industrieën.
Uitzonderingen:
De wet van behoud van massa geldt voor de meeste gewone chemische reacties. Het is echter niet van toepassing op nucleaire reacties waarbij massa kan worden omgezet in energie (zoals beschreven door Einstein's beroemde vergelijking E =mc²).
 Waarom zijn waterstofionen plus als het H2O is?
Waarom zijn waterstofionen plus als het H2O is?  Wat zijn de functies van condensatoren in microscopen?
Wat zijn de functies van condensatoren in microscopen?  Wat is dynamisch evenwicht beschrijven wat er gebeurt met de vloeistof en damp aan de grens van een die in de algemene balans verandert?
Wat is dynamisch evenwicht beschrijven wat er gebeurt met de vloeistof en damp aan de grens van een die in de algemene balans verandert?  Fluorescerende breathalyzer maakt optimalisatie van katalysatoren veel gemakkelijker
Fluorescerende breathalyzer maakt optimalisatie van katalysatoren veel gemakkelijker Wat is chemestry?
Wat is chemestry?
 Als we zien dat voedsel wordt verspild, worden we gek - maar zou dat ook moeten?
Als we zien dat voedsel wordt verspild, worden we gek - maar zou dat ook moeten? Obama houdt hartstochtelijk pleidooi voor schone energie in Argentinië
Obama houdt hartstochtelijk pleidooi voor schone energie in Argentinië Amerikaanse en Iraanse onderzoekers werken samen aan herstel van het Urmia-meer
Amerikaanse en Iraanse onderzoekers werken samen aan herstel van het Urmia-meer Hoe overheden zich verzetten tegen vermeldingen van Werelderfgoed in gevaar
Hoe overheden zich verzetten tegen vermeldingen van Werelderfgoed in gevaar Wat verwijst naar een reeks verticale zones met onderscheidende klimaat- en vegetatieregimes?
Wat verwijst naar een reeks verticale zones met onderscheidende klimaat- en vegetatieregimes?
Hoofdlijnen
- Hoe krijgen gekleurde planten hun eten?
- Neuroimaging laat zien hoe ideologie de perceptie van ras beïnvloedt
- Hoe informatie buiten de genetische sequentie wordt gecodeerd in plantensperma
- Wat is de oudste bekende vorm van leven?
- Waar trekt het drugsmetabolisme op?
- Wat is de naam van theorie die stelt dat soorten evolueren tijdens korte periodes snelle verandering?
- Onderzoekers ontdekken sleutelfuncties van therapeutisch veelbelovende jumbovirussen
- Wat is de wetenschappelijke methode in orde?
- Zouden pijnvrije dieren een humanere hamburger maken?
- SmartFarm-apparaat oogst luchtvochtigheid voor autonoom, zelfvoorzienende stadslandbouw

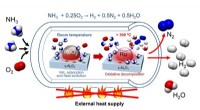
- Katalysator voor de koolstofvrije productie van waterstofgas uit ammoniak
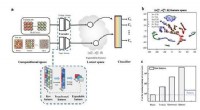
- Kristalstructuurvoorspelling van willekeurige legering met meerdere elementen
- Onderzoekers ontdekken dat ruimte tussen polymeerketens de energieconversie beïnvloedt

- Chemische beeldvorming gebruikt om de diagnose van darmkanker te vergemakkelijken

 Wijn die de ruimte in ging met een prijskaartje van $ 1 miljoen
Wijn die de ruimte in ging met een prijskaartje van $ 1 miljoen Vernietigt spuitverf de ozon?
Vernietigt spuitverf de ozon?  Wil je vooroordelen op de werkvloer elimineren? Let op uw beoordelingssysteem, studie zegt:
Wil je vooroordelen op de werkvloer elimineren? Let op uw beoordelingssysteem, studie zegt: Wat maakt protistisch dierachtig?
Wat maakt protistisch dierachtig?  Wat is verwering en erosie, wat erosie verklaart?
Wat is verwering en erosie, wat erosie verklaart?  Voyager 2 verlicht de grens van de interstellaire ruimte
Voyager 2 verlicht de grens van de interstellaire ruimte Wat is het smeltpunt van het atoomnummer massa en of kookt van element nikkel?
Wat is het smeltpunt van het atoomnummer massa en of kookt van element nikkel?  Muziek verbindt gevangenen in Noorse gevangenissen met de buitenwereld
Muziek verbindt gevangenen in Noorse gevangenissen met de buitenwereld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

