
Wetenschap
Wat zorgt ervoor dat de deeltjes van een stof in een bepaalde fase zijn in plaats van een andere?
Hier is een uitsplitsing:
* Kinetische energie: Dit is de energie van beweging. Hoe hoger de temperatuur, hoe meer kinetische energie de deeltjes hebben en hoe sneller ze bewegen.
* aantrekkelijke krachten: Dit zijn krachten die de deeltjes bij elkaar houden. Ze kunnen te wijten zijn aan verschillende interacties, zoals waterstofbinding, dipool-dipoolkrachten of Londense dispersiekrachten.
Laten we elke fase in meer detail bekijken:
solide:
* Sterke aantrekkelijke krachten: De deeltjes zijn strak verpakt en bij elkaar gehouden door sterke aantrekkelijke krachten.
* Lage kinetische energie: De deeltjes trillen in vaste posities, maar ze hebben niet genoeg energie om de aantrekkelijke krachten te overwinnen en vrij te bewegen.
* Vaste vorm en volume: Vaste stoffen hebben een duidelijke vorm en volume omdat de deeltjes zijn vergrendeld in een stijve structuur.
vloeistof:
* Matige aantrekkelijke krachten: De deeltjes zijn dichter bij elkaar dan in een gas, maar ze kunnen nog steeds om elkaar heen bewegen.
* Matige kinetische energie: De deeltjes hebben voldoende energie om enkele van de aantrekkelijke krachten te overwinnen, waardoor ze langs elkaar kunnen bewegen.
* Vaste volume maar geen vorm: Vloeistoffen nemen de vorm van hun container aan maar behouden een vast volume.
gas:
* Zwakke aantrekkelijke krachten: De deeltjes liggen ver uit elkaar en hebben zeer zwakke aantrekkelijke krachten tussen hen.
* Hoge kinetische energie: De deeltjes bewegen zeer snel en willekeurig, botsen tegen elkaar en de wanden van hun container.
* Geen vaste vorm of volume: Gassen nemen de vorm en het volume van hun container aan omdat de deeltjes constant bewegen en verspreiden.
Faseveranderingen:
Veranderingen in temperatuur en druk beïnvloeden de balans tussen kinetische energie en aantrekkelijke krachten, wat leidt tot faseveranderingen:
* Verwarming: Verhoogt kinetische energie, waardoor het voor deeltjes gemakkelijker wordt om aantrekkelijke krachten te overwinnen en over te stappen naar een minder geordende toestand (vast tot vloeistof, vloeistof naar gas).
* Koeling: Vermindert kinetische energie, waardoor het waarschijnlijker is dat aantrekkelijke krachten domineren en deeltjes om over te stappen naar een meer geordende toestand (gas naar vloeistof, vloeistof tot vast).
* toenemende druk: Dwingt deeltjes dichter bij elkaar, waardoor de invloed van aantrekkelijke krachten toeneemt en een meer gecondenseerde toestand (gas tot vloeistof, vloeistof tot vast) de voorkeur geven.
* Dalende druk: Hiermee kunnen deeltjes verder uit elkaar bewegen, waardoor de aantrekkelijke krachten worden verzwakt en een meer uitgebreide toestand bevoordelen (vaste stof tot vloeistof, vloeistof tot gas).
Samenvattend wordt de fase van een stof bepaald door de delicate balans tussen de krachten die zijn deeltjes bij elkaar houden en de energie die ze bezitten. Veranderingen in temperatuur en druk kunnen deze balans verleggen, wat leidt tot overgangen tussen vaste, vloeistof en gasvormige toestanden.
 Wat zijn de toeschouwerionen in reactie 2KOH plus H2SO4 en gt2H2O K2SO4?
Wat zijn de toeschouwerionen in reactie 2KOH plus H2SO4 en gt2H2O K2SO4?  Op metaal gebaseerde verbindingen maken de weg vrij voor nieuwe antivirale behandelingen
Op metaal gebaseerde verbindingen maken de weg vrij voor nieuwe antivirale behandelingen Welk diatomee molecuul wordt verbonden door drievoudige covalente binding?
Welk diatomee molecuul wordt verbonden door drievoudige covalente binding?  Wat is de molmassa van staal?
Wat is de molmassa van staal?  Kun je een diamant smelten en mengen met calciet?
Kun je een diamant smelten en mengen met calciet?
 Aanhoudendere weerpatronen in de VS die verband houden met de opwarming van het noordpoolgebied
Aanhoudendere weerpatronen in de VS die verband houden met de opwarming van het noordpoolgebied Bestrijdingsmiddelenmengsels groter probleem dan eerder gedacht
Bestrijdingsmiddelenmengsels groter probleem dan eerder gedacht NASA ontdekt dat de wolken van de tropische cycloon Eliakim opwarmen
NASA ontdekt dat de wolken van de tropische cycloon Eliakim opwarmen Een nieuwe gletsjerwebsite uit de Oostenrijkse Alpen
Een nieuwe gletsjerwebsite uit de Oostenrijkse Alpen Riffen die frequente temperatuurveranderingen ondergaan, zijn hoogstwaarschijnlijk bestand tegen koraalverbleking
Riffen die frequente temperatuurveranderingen ondergaan, zijn hoogstwaarschijnlijk bestand tegen koraalverbleking
Hoofdlijnen
- Wat is een Hyocaust -systeem?
- Zijn kankersoorten nieuw ontwikkelde soorten?
- Luiheid heeft deze menselijke voorouder misschien verdoemd
- Nieuwe strategie zou bestaande medicijnen in staat kunnen stellen bacteriën te doden die chronische infecties veroorzaken
- Wat is de hoofdklier die veel hormonen produceert en de functie van andere endocriene klieren controleert?
- Wat is de wetenschappelijke naam voor Phylum Protozoa?
- 1 Leg uit waarom de bloedsomloop van een walvis als een orgaansysteem wordt beschouwd?
- Drang om samen te voegen:begrijpen hoe cellen samensmelten
- Wat veroorzaakt een stressor binnen een organisme?
- MOF-gebaseerde sensor voor het testen van de waterkwaliteit

- Betere thermo-elektrische eigenschappen bereikt in n-type composiet

- Switch-in-a-cell elektriseert het leven
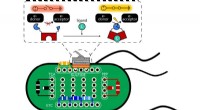
- Bioactieve papiercoatings ter vervanging van plastic voor het verpakken van voedsel

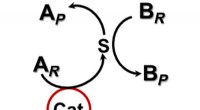
- Chemische reacties versnellen zonder direct contact met een katalysator
 Wat gebeurde er met de grotere asteroïde Didymos nadat DART op Dimorphous was ingeslagen?
Wat gebeurde er met de grotere asteroïde Didymos nadat DART op Dimorphous was ingeslagen?  Spannende race tegen de klok om de geheimen van Vikingschepen te ontrafelen
Spannende race tegen de klok om de geheimen van Vikingschepen te ontrafelen Hevige regenval orkaan Michaels gemeten door NASA
Hevige regenval orkaan Michaels gemeten door NASA Hoe watertestresultaten te lezen
Hoe watertestresultaten te lezen  Oude krokodillenstamboom onthult onverwachte wendingen
Oude krokodillenstamboom onthult onverwachte wendingen De lus sluiten voor robotgrijpen
De lus sluiten voor robotgrijpen Onderzoekers ontwikkelen nieuw tumorkrimpend nanodeeltje om kanker te bestrijden herhaling voorkomen
Onderzoekers ontwikkelen nieuw tumorkrimpend nanodeeltje om kanker te bestrijden herhaling voorkomen Op jacht naar donkere quarks
Op jacht naar donkere quarks
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

