
Wetenschap
Een emissiespectrum van een atoom wordt geproduceerd wanneer de elektronen zijn.
Hier is een uitsplitsing:
* excitatie: Wanneer een atoom energie absorbeert (van warmte, licht of andere bronnen), springen de elektronen van hun grondtoestand naar hogere energieniveaus. Dit wordt excitatie genoemd.
* De-excitatie: De opgewonden elektronen zijn onstabiel en willen terugkeren naar hun lagere energieniveaus. Om dit te doen, geven ze de geabsorbeerde energie vrij in de vorm van licht.
* emissiespectrum: Het uitgezonden licht bestaat uit specifieke golflengten (kleuren) die overeenkomen met de energieverschillen tussen de energieniveaus van het elektron. Dit unieke patroon van golflengten is het emissiespectrum van het atoom.
Zie het zo:
* Stel je een ladder voor: De sporten van de ladder vertegenwoordigen energieniveaus.
* Een elektron beklimt de ladder: Het absorbeert energie en springt naar een hogere sport.
* Het elektron valt terug naar beneden: Het geeft energie vrij in de vorm van licht terwijl het afdaalt naar lagere sports.
Elke "stap" naar beneden de ladder geeft een specifieke kleur van het licht vrij en draagt bij aan het unieke emissiespectrum van het atoom.
 Het eerste hydrogelplatform in zijn soort maakt on-demand productie van medicijnen mogelijk, Chemicaliën
Het eerste hydrogelplatform in zijn soort maakt on-demand productie van medicijnen mogelijk, Chemicaliën Beeldvormingstechniek kan een game-wisselaar zijn voor de farma
Beeldvormingstechniek kan een game-wisselaar zijn voor de farma Wie maakt Thiaminehydrochloride?
Wie maakt Thiaminehydrochloride?  Wat is de dichtheid van bariumchloride in water?
Wat is de dichtheid van bariumchloride in water?  Brandstofcel zorgt voor een frisse wind voor toekomstig stroomalternatief
Brandstofcel zorgt voor een frisse wind voor toekomstig stroomalternatief
 Heeft de invloed van koude op de invloed van objecten op metaal?
Heeft de invloed van koude op de invloed van objecten op metaal?  Oude vulkanen onthullen de gerecyclede aardkorst
Oude vulkanen onthullen de gerecyclede aardkorst Als het regent, het giet - de effecten van regenwaterafvoer
Als het regent, het giet - de effecten van regenwaterafvoer Het gebruik van bossen om de CO2-uitstoot te compenseren vereist inzicht in de risico's
Het gebruik van bossen om de CO2-uitstoot te compenseren vereist inzicht in de risico's Rocky Mountain niet zo hoog:olie, gasbronnen doen de huizenwaarden in Colorado dalen
Rocky Mountain niet zo hoog:olie, gasbronnen doen de huizenwaarden in Colorado dalen
Hoofdlijnen
- Fruit met een centraal zaadje dat een kern bevat, omgeven door een dikke laag vlees worden geclassificeerd als?
- Hoe biofilms werken
- Wat zijn de biomoleculen van koolhydraten?
- Houd je van slangen, hagedissen en kikkers? Waarom herpetologie de carrière voor zou kunnen zijn
- Pakken of niet aaien? Hoe de interactie tussen kinderen en honden veilig te houden
- Wanneer u wetenschappelijke methoden gebruikt om een probleem op te lossen, is wetenschapper waarschijnlijk dat het doet na het vormen van hypothese?
- Een model van een plantencel in een plastic zak maken
- Verstikt, gewurgd en verdronken. Hoe plastic zakken met ballonnen zeedieren doden
- Langoustines hongeren naar kwallen gevangen op camera
- Stazakken van hernieuwbare grondstoffen en nanocellulose

- Onderzoekers produceren 50x stabieler adsorbens
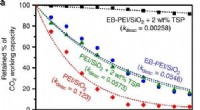
- Technologie onthult voorheen niet-detecteerbare eiwitsignaleringsactiviteit bij diabetes, kanker

- Een milieuvriendelijke methode voor de synthese van kaneelaldehyde
- Van superafdichtingen tot de detectie van gevaarlijke kabels dankzij ionenstralen

 Hoe enorme overstromingen en complexe infrastructuur de ondergang van het oude Angkors hadden kunnen veroorzaken?
Hoe enorme overstromingen en complexe infrastructuur de ondergang van het oude Angkors hadden kunnen veroorzaken? Graan, pollen van olijf- en wijnstokken onthullen marktintegratie in het oude Griekenland
Graan, pollen van olijf- en wijnstokken onthullen marktintegratie in het oude Griekenland Het gebruik van sociale media door kinderen creëert een nieuw type digital native
Het gebruik van sociale media door kinderen creëert een nieuw type digital native Wat gebeurt er als voorwerpen met een verschillende massa onder dezelfde zwaartekrachtomstandigheden vallen?
Wat gebeurt er als voorwerpen met een verschillende massa onder dezelfde zwaartekrachtomstandigheden vallen?  Bewijs van meerdere ongecontroleerde lozingen van kolenas gevonden in het N.C.-meer
Bewijs van meerdere ongecontroleerde lozingen van kolenas gevonden in het N.C.-meer Studie belicht botanische vooroordelen
Studie belicht botanische vooroordelen Hoeveel gram in 1 pond mineraal?
Hoeveel gram in 1 pond mineraal?  Ideeën voor harde wetenschap Eerlijke projecten
Ideeën voor harde wetenschap Eerlijke projecten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

