
Wetenschap
Waarom zijn alkali -metalen reactiever dan overgangsmetalen?
1. Elektronenconfiguratie:
* Alkali metalen Heb een enkele valentie -elektron in hun buitenste schaal (NS¹). Dit elektron wordt losjes vastgehouden en gemakkelijk verloren, waardoor ze zeer reactief zijn.
* overgangsmetalen Heb meerdere elektronen in hun D -orbitalen, waardoor ze stabieler zijn en minder snel elektronen verliezen.
2. Ionisatie -energie:
* Alkali metalen hebben lage ionisatie -energieën. Dit betekent dat het relatief weinig energie nodig heeft om het elektron met enkele valentie te verwijderen, wat resulteert in de vorming van een +1 ion.
* overgangsmetalen Over het algemeen hebben hogere ionisatie -energieën vanwege de meerdere elektronen in hun D -orbitalen, waardoor het moeilijker is om elektronen te verwijderen.
3. Elektropositiviteit:
* Alkali metalen zijn zeer elektropositief, wat betekent dat ze een sterke neiging hebben om elektronen te verliezen en positieve ionen te vormen. Dit maakt ze erg reactief, vooral met niet -metalen.
* overgangsmetalen zijn over het algemeen minder elektropositief in vergelijking met alkali -metalen.
4. Metallic binding:
* Alkali metalen hebben zwakke metaalbinding als gevolg van het elektron van enkele valentie. Deze zwakkere binding draagt bij aan hun reactiviteit.
* overgangsmetalen hebben sterke metalen binding vanwege de meerdere elektronen in hun D -orbitalen. Deze sterke binding draagt bij aan hun relatieve stabiliteit en lagere reactiviteit.
5. Afscherming:
* Alkali metalen hebben slechts één elektronenschil tussen de kern en het valentie -elektron. Met deze zwakke afscherming kan het valentie -elektron gemakkelijk worden verwijderd.
* overgangsmetalen hebben meerdere elektronenschalen, wat leidt tot een sterkere afscherming van de valentie -elektronen van de kern.
Samenvattend:
De combinatie van een enkele valentie -elektron, lage ionisatie -energie, hoge elektropositiviteit, zwakke metaalbinding en zwakke afscherming maken alkali -metalen zeer reactief in vergelijking met overgangsmetalen.
 Houd het simpel:het synthetiseren van nuttige organische verbindingen is nu gemakkelijker en goedkoper gemaakt
Houd het simpel:het synthetiseren van nuttige organische verbindingen is nu gemakkelijker en goedkoper gemaakt Verborgen vervormingen leiden tot veelbelovende thermo-elektrische eigenschappen
Verborgen vervormingen leiden tot veelbelovende thermo-elektrische eigenschappen Kooldioxide binden met gebroken beton
Kooldioxide binden met gebroken beton Waarom verandert water van een vaste stof naar vloeistof wanneer verwarmd?
Waarom verandert water van een vaste stof naar vloeistof wanneer verwarmd?  Maakt een element deel uit van het periodiek systeem?
Maakt een element deel uit van het periodiek systeem?
Hoofdlijnen
- Welk phylum zijn orang -oetans?
- Biologische uitsmijters:hoe immuuncellen antigenen van oppervlakken rukken om te leren en te evolueren
- Wat zijn de zintuigen van amfibieën?
- Onderzoekers gezocht:mensen hoeven niet te solliciteren?
- Een ecologische afweging? Zonne-energie op nutsschaal belemmert bedreigde panters uit Florida
- 10 planten verloren in de geschiedenis
- Was Tricia de olifant gelukkig? Experts bespreken de ethiek van het in gevangenschap houden van zulke grote, rondzwervende wezens
- Wat doen zowel zaden als planten voordat ze beginnen te groeien?
- Hoe de genetische blauwdrukken voor ledematen van vissen kwamen
- Begrijpen hoe een katalysator methaan omzet in etheen kan het affakkelen van aardgas voorkomen

- Op maat gemaakte molecule is veelbelovend als antikankertherapie
- Door resonantie versterkte tunneling induceert fluor- en para-waterstofreactie in interstellaire wolken

- Olie opruimen met magneten
- Polymeren klikken samen met behulp van groene chemie
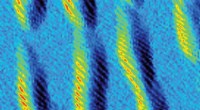
 Welke organismen vormen een fossiel?
Welke organismen vormen een fossiel?  Atoom voor atoom:structurele transformaties in 2D-materialen in beeld brengen
Atoom voor atoom:structurele transformaties in 2D-materialen in beeld brengen  Is metaal een geleider of isolator?
Is metaal een geleider of isolator?  Onderzoekers rapporteren over ontdekking om zonne-energie goedkoper en efficiënter te maken
Onderzoekers rapporteren over ontdekking om zonne-energie goedkoper en efficiënter te maken Stedelijk regenwater kan verontreinigingen op de grond afgeven, oppervlaktewateren
Stedelijk regenwater kan verontreinigingen op de grond afgeven, oppervlaktewateren Doorbraak in microscopie maakt de weg vrij voor atomair nauwkeurige fabricage
Doorbraak in microscopie maakt de weg vrij voor atomair nauwkeurige fabricage Hoe 'ijsnaalden' patronen van stenen weven in bevroren landschappen
Hoe 'ijsnaalden' patronen van stenen weven in bevroren landschappen  Het planningssysteem in Engeland houdt raciale ongelijkheid in stand
Het planningssysteem in Engeland houdt raciale ongelijkheid in stand
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

