
Wetenschap
Wat zijn dingen die een reactiesnelheid verlagen?
1. Verlaagt temperatuur:
* Kinetische energie: Reacties treden op wanneer moleculen botsen met voldoende energie om bindingen te verbreken en nieuwe te vormen. Verlaagt temperatuur vermindert de gemiddelde kinetische energie van moleculen, wat leidt tot minder succesvolle botsingen.
* Activeringsenergie: Elke reactie heeft een activeringsenergiebarrière die moleculen moeten overwinnen om te reageren. Lagere temperaturen maken het voor moleculen moeilijker om dit energieniveau te bereiken.
2. Afnemende concentratie van reactanten:
* Botsfrequentie: Hogere reactantconcentraties betekenen dat er meer moleculen aanwezig zijn, waardoor de kans op botsingen tussen reactantmoleculen vergroot. Het verlagen van de concentraties vermindert de botsfrequentie, waardoor de reactie wordt vertraagd.
3. Verhogende activeringsenergie:
* Activeringsenergiebarrière: De activeringsenergie is de minimale energie die nodig is om een reactie te laten optreden. Het verhogen van de activeringsenergiebarrière maakt het voor moleculen moeilijker om het nodige energieniveau te bereiken, waardoor de reactie wordt vertraagd. Dit kan worden veroorzaakt door:
* Introductie van een katalysator die de reactie vertraagt (een negatieve katalysator).
* Verander het reactiemedium (bijv. Met behulp van een ander oplosmiddel).
4. Verhogend oppervlak:
* heterogene reacties: Reacties met stoffen in verschillende fasen (bijvoorbeeld vaste en vloeistof) worden beïnvloed door het oppervlak. Een groter oppervlak biedt meer contactpunten voor de reactanten, waardoor de reactiesnelheid wordt verhoogd. Het afnemende oppervlak vermindert echter de contactpunten, waardoor de reactie wordt vertraagd.
5. Een katalysator toevoegen die de reactie vertraagt:
* katalysatoren: Hoewel de meeste katalysatoren reacties versnellen, zijn er enkele die kunnen werken als negatieve katalysatoren en reacties kunnen vertragen. Deze katalysatoren verhogen de activeringsenergie, waardoor het moeilijker is om de reactie op te treden.
6. Verander de fase van reactanten:
* reactiesnelheden in verschillende fasen: Reacties zijn meestal sneller in de gasfase in vergelijking met de vloeibare fase en zelfs langzamer in de vaste fase. Dit komt door de toegenomen bewegingsvrijheid en botsingsfrequentie in gassen.
7. Het vergroten van de gedeeltelijke druk van inerte gassen:
* Botsfrequentie: In een gasmengsel vermindert het toevoegen van inerte gassen de gedeeltelijke druk van reactanten, wat leidt tot minder botsingen tussen reactantmoleculen en het verminderen van de reactiesnelheid.
8. Een product toevoegen aan het reactiemengsel:
* LE Chatelier's principe: Volgens het principe van Le Chatelier verschuift het toevoegen van een product aan een reactiemengsel het evenwicht naar de reactanten, waardoor de voorwaartse reactie wordt vertraagd.
Voorbeeld:
Stel je een kampvuur voor. Door meer hout (toenemende concentratie) toe te voegen en op het vuur te blazen (toenemende temperatuur) zal het sneller laten branden. Omgekeerd zal het bedekken van het vuur met as (afnemende oppervlakte -oppervlak) en het gebruik van nat hout (verlagingstemperatuur) het brandende proces vertragen.
 Vuile data:bedrijven rekenen milieukosten van de digitale planeet
Vuile data:bedrijven rekenen milieukosten van de digitale planeet Het watergebruik voor fracken is sinds 2011 met tot wel 770 procent gestegen
Het watergebruik voor fracken is sinds 2011 met tot wel 770 procent gestegen Inzicht in de gevoeligheid van bodemkoolstof voor stijgende temperaturen op aarde
Inzicht in de gevoeligheid van bodemkoolstof voor stijgende temperaturen op aarde  Dodental overstromingen Zuid-Azië boven de 1, 000
Dodental overstromingen Zuid-Azië boven de 1, 000 Wat zijn vier niet-levende dingen in een woestijnecosysteem?
Wat zijn vier niet-levende dingen in een woestijnecosysteem?
Hoofdlijnen
- Zwarte geit gaat weer gedijen in Israël
- Het weer in november is een lastige tijd voor schildpadden
- Ondergaat elk type levend wezen een evolutie?
- Er sterft een massale vissterfte in Vietnam terwijl Zuidoost-Azië door een hittegolf wordt geteisterd
- Voor altijd fido? Zuid-Koreaanse hondenkloonkliniek
- Wat wordt bedoeld met diamorfisme?
- Wat is een kenmerken van archeebacteriën?
- Cellulaire ademhaling: definitie, vergelijking en stappen
- Verandering in de gencode kan verklaren hoe menselijke voorouders staarten verloren
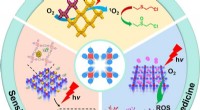
- Recente vorderingen in de ontwikkeling van foto- en elektroactieve waterstofgebonden organische raamwerken
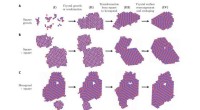
- Team ontdekt dat polymorfe selectie tijdens kristalgroei thermodynamisch kan worden aangestuurd
- Wetenschappers ontwikkelen een goedkopere methode die kan helpen bij het maken van brandstoffen uit planten

- Methoden voor machinaal leren bieden nieuwe inzichten in organisch-anorganische interfaces

- Biostasis heeft tot doel de dood na traumatisch letsel te voorkomen door biochemische reacties in cellen te vertragen

 Welke dieren eten klaver?
Welke dieren eten klaver?  Per saldo, sommige neonicotinoïde pesticiden kunnen bijen ten goede komen:studie
Per saldo, sommige neonicotinoïde pesticiden kunnen bijen ten goede komen:studie Frankrijk klimt aan boord van waterstoftreinrevolutie
Frankrijk klimt aan boord van waterstoftreinrevolutie Mars trekt aan:hoe de interacties van de aarde met de rode planeet de diepzeecirculatie stimuleren
Mars trekt aan:hoe de interacties van de aarde met de rode planeet de diepzeecirculatie stimuleren  Abba:Wie vindt ze eigenlijk leuk?
Abba:Wie vindt ze eigenlijk leuk?  Fracking the future:hoe de Congolese oliewinning zijn geschiedenis en lot heeft gevormd
Fracking the future:hoe de Congolese oliewinning zijn geschiedenis en lot heeft gevormd  Hoe de Heilige Geest aan vijfjarigen te verklaren
Hoe de Heilige Geest aan vijfjarigen te verklaren  Welke planten leven in de sneeuw?
Welke planten leven in de sneeuw?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

