
Wetenschap
Wat gebeurt er met de temperatuur van het ijs als u wat zout toevoegt?
* Freezing Point Depression: Zout lost op in water en creëert een oplossing met een lager vriespunt dan zuiver water. Het vriespunt van zuiver water is 0 ° C (32 ° F), maar het vriespunt van een zoutoplossing is lager.
* smeltend ijs: Omdat zout aan ijs wordt toegevoegd, lost het op in de dunne laag water die zich natuurlijk op het ijsoppervlak vormt. Dit creëert een zoutoplossing met een lager vriespunt. Om dit lagere vriespunt te bereiken, moet een deel van het ijs smelten.
* Energieabsorptie: Het smelten van ijs vereist energie. Deze energie wordt geabsorbeerd uit de omliggende omgeving, inclusief het resterende ijs. Deze absorptie van energie leidt tot een daling van de temperatuur van het ijs.
Denk er zo aan:
Stel je ijsblokjes voor in een glas water. De ijsblokjes zijn op 0 ° C (32 ° F). Wanneer u zout toevoegt, lost het zout op in het water, waardoor een zoute oplossing ontstaat. Deze oplossing heeft nu een lager vriespunt, zeg -5 ° C (23 ° F). Om dit nieuwe vriespunt te bereiken, moet een deel van het ijs smelten. Dit smeltproces absorbeert energie van het resterende ijs, waardoor de temperatuur onder 0 ° C daalt.
Dit effect is waarom zout wordt gebruikt om ijs te smelten op wegen en trottoirs in de winter. Het zout verlaagt het vriespunt van het ijs, waardoor het zelfs bij temperaturen onder 0 ° C (32 ° F) smelt.
Laat het me weten als je meer wilt weten over de details van vriespuntdepressie of andere interessante effecten van zout op ijs!
 Doorbraak in het benutten van de kracht van biologische katalysatoren
Doorbraak in het benutten van de kracht van biologische katalysatoren Element vergelijkbaar met helium en neon?
Element vergelijkbaar met helium en neon?  Designer-eiwitten vormen draden en roosters op een mineraal oppervlak
Designer-eiwitten vormen draden en roosters op een mineraal oppervlak Nieuwe chemische methode vereenvoudigt modificatie in een laat stadium van medicijnverbindingen
Nieuwe chemische methode vereenvoudigt modificatie in een laat stadium van medicijnverbindingen Is verdamping hetzelfde als koken?
Is verdamping hetzelfde als koken?
 Hoe 'Dune' een baken werd voor de jonge milieubeweging en een strijdkreet voor de nieuwe wetenschap van de ecologie
Hoe 'Dune' een baken werd voor de jonge milieubeweging en een strijdkreet voor de nieuwe wetenschap van de ecologie  Waarom de Victoria Plate in Afrika roteert
Waarom de Victoria Plate in Afrika roteert Carbon Cycling in Aquatic Ecosystems
Carbon Cycling in Aquatic Ecosystems  Uit analyse blijkt dat Amerikaanse ecosystemen honderden kilometers naar het noorden verschuiven
Uit analyse blijkt dat Amerikaanse ecosystemen honderden kilometers naar het noorden verschuiven Microscopisch leven in de zoute bodem van het natuurpark Marismas del Odiel
Microscopisch leven in de zoute bodem van het natuurpark Marismas del Odiel
Hoofdlijnen
- Wat is een recombinatie -breekpunt?
- Wat betekent ‘Kaukasisch’ werkelijk?
- Sommige apen die vatbaar zijn voor isolatie
- Wat is het verschil tussen onderzoek in het veld en het laboratorium?
- Wat zijn de suikertransporterende cellen in angiospermen?
- Onderzoekers gebruiken cryo-elektronenmicroscopie om te leren hoe DNA zich strak om nucleosomen wikkelt
- Welke weefsels komen voor in planten en dieren?
- Welke twee lichaamssystemen werken samen om zuurstof door het lichaam te sturen?
- Wat doet het exdocriene systeem?
- Nederlandse koningin en robot openen 3D-geprinte brug in Amsterdam

- Wetenschappers onderzoeken racemasen en stellen strategieën voor om medicijnen te vinden die zich richten op deze belangrijke enzymen
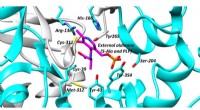
- Beoordeling van het begin van calciumfosfaatkiemvorming door gehyperpolariseerde real-time NMR

- Het onzichtbare zien - een nieuw gasbeeldvormingssysteem
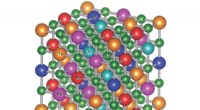
- Ongeordende materialen kunnen het moeilijkst zijn, meest hittebestendige carbiden
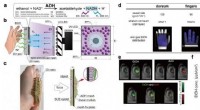
 Nieuwe vingertopsensoren om veteranen te helpen door hun prothese heen te voelen
Nieuwe vingertopsensoren om veteranen te helpen door hun prothese heen te voelen Nationale dienst voor het milieu - wat een leger jonge natuurbeschermers zou kunnen bereiken
Nationale dienst voor het milieu - wat een leger jonge natuurbeschermers zou kunnen bereiken Is warmte de overdracht van potentiële energie?
Is warmte de overdracht van potentiële energie?  Welke soorten vectoren worden gebruikt om DNA van de ene soort naar de andere soort te transporteren?
Welke soorten vectoren worden gebruikt om DNA van de ene soort naar de andere soort te transporteren?  Is NH4 plus een binaire verbinding?
Is NH4 plus een binaire verbinding?  Taalsnelheid versus efficiëntie:is sneller beter?
Taalsnelheid versus efficiëntie:is sneller beter?  Astrofysici meten voor het eerst een nauwkeurig rotatiepatroon van zonachtige sterren
Astrofysici meten voor het eerst een nauwkeurig rotatiepatroon van zonachtige sterren Radioamateurs bellen:help OPS-SAT te vinden!
Radioamateurs bellen:help OPS-SAT te vinden!
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

