
Wetenschap
Hoe pakt een element extra elektronen of verlies op om ionen te vormen?
De basis
* atomen: De fundamentele bouwstenen van materie, bestaande uit protonen, neutronen en elektronen.
* protonen: Positief geladen deeltjes in de kern van het atoom.
* neutronen: Neutraal geladen deeltjes in de kern van het atoom.
* elektronen: Negatief geladen deeltjes die de kern in schelpen draaien.
* ionen: Atomen die elektronen hebben gewonnen of verloren, wat resulteert in een netto positieve of negatieve lading.
Hoe elementen ionen vormen
Atomen streven ernaar om een stabiele configuratie te bereiken, meestal met een volledige buitenste elektronenschil (ook wel de valentie -schaal genoemd). Dit wordt vaak de "octetregel" genoemd, wat betekent dat atomen de neiging hebben om elektronen te winnen, verliezen of delen om acht elektronen in hun buitenste schaal te hebben.
het verkrijgen van elektronen (anionen)
* niet -metalen: Niet -metalen hebben over het algemeen een hoge elektronegativiteit, wat betekent dat ze een sterke aantrekkingskracht hebben op elektronen.
* proces: Om een stabiele configuratie te bereiken, hebben niet -metalen de neiging om elektronen te krijgen.
* resultaat: Door elektronen te winnen, worden ze negatief geladen ionen die anionen worden genoemd. Chloor (CL) krijgt bijvoorbeeld één elektron als chloride (CL⁻).
Elektronen verliezen (kationen)
* metalen: Metalen hebben over het algemeen een lage elektronegativiteit, wat betekent dat ze eerder elektronen verliezen.
* proces: Om een stabiele configuratie te bereiken, verliezen metalen de neiging elektronen te verliezen.
* resultaat: Door elektronen te verliezen, worden ze positief geladen ionen die kationen worden genoemd. Natrium (NA) verliest bijvoorbeeld één elektron om natriumion te worden (Na⁺).
factoren die de vorming van ionen beïnvloeden
* elektronegativiteit: Het relatieve vermogen van een atoom om elektronen aan te trekken. Grotere elektronegativiteitsvoorzieningen die elektronen verwerven, terwijl lagere elektronegativiteit voorstanders van het verliezen van elektronen.
* ionisatie -energie: De energie die nodig is om een elektron uit een atoom te verwijderen. Lagere ionisatie -energie maakt het gemakkelijker om elektronen te verliezen.
* Elektronenaffiniteit: De energieverandering die optreedt wanneer een elektron wordt toegevoegd aan een neutraal atoom. Hogere elektronenaffiniteit maakt het waarschijnlijker dat het elektronen krijgt.
voorbeelden
* Natrium (NA) vormt NA⁺: Natrium heeft één elektron in zijn buitenste schaal. Het verliest dit elektron om stabiel te worden en vormt een kation met een +1 lading.
* chloor (CL) vormt Cl⁻: Chloor heeft zeven elektronen in zijn buitenste schaal. Het krijgt één elektron om zijn octet te voltooien, waardoor een anion met een -1 lading wordt gevormd.
Key Points
* Ionvorming wordt aangedreven door de wens om een stabiele elektronenconfiguratie te bereiken.
* Elementen met lage ionisatie -energie hebben de neiging om kationen te vormen.
* Elementen met hoge elektronegativiteit hebben de neiging anionen te vormen.
* Ionen spelen cruciale rollen bij chemische binding, die ionische verbindingen vormen.
 Superstaalproject bereikt grote doorbraak
Superstaalproject bereikt grote doorbraak Zijn ionische verbindingen gemaakt van metaal en niet-metaal?
Zijn ionische verbindingen gemaakt van metaal en niet-metaal?  Onderzoekers leggen de unieke onderliggende atomaire structuur van PNCP-metaalglas uit
Onderzoekers leggen de unieke onderliggende atomaire structuur van PNCP-metaalglas uit Eenvoudig apparaat bewaakt de gezondheid met behulp van zweet
Eenvoudig apparaat bewaakt de gezondheid met behulp van zweet Onderzoekers synthetiseren met succes kankermiddel thapsigargin
Onderzoekers synthetiseren met succes kankermiddel thapsigargin
 Parijs wil dieselauto's tegen 2024 uitfaseren
Parijs wil dieselauto's tegen 2024 uitfaseren NASA vindt zware regen in nieuwe tropische cycloon Hilda
NASA vindt zware regen in nieuwe tropische cycloon Hilda Landherstel in Latijns-Amerika toont groot potentieel voor mitigatie van klimaatverandering
Landherstel in Latijns-Amerika toont groot potentieel voor mitigatie van klimaatverandering Veranderingen in zeetemperatuur die bijdragen aan droogte
Veranderingen in zeetemperatuur die bijdragen aan droogte Ambtenaren in Californië dagen fracking van kustlijn uit
Ambtenaren in Californië dagen fracking van kustlijn uit
Hoofdlijnen
- Wetenschappers onthullen hoe bacteriën huizen bouwen in gezonde cellen
- Luipaarden doden minstens 3 kinderen op het Indiase platteland
- Wat is de klier van de buik?
- Hoeveel chromosomen van geslacht heeft een mannelijk embryo?
- Waarom fruit rijpt en bloemen afsterven:Wetenschappers ontdekken hoe belangrijke plantenhormonen worden geactiveerd
- Wat is de rol van Dessicant in Dessicator?
- Wat is de oorsprong van amylase?
- Wat zijn enkele kenmerken van DNA?
- Oude beenviskrachten heroverwegen hoe haaien evolueerden
- Multifunctionele droom keramische matrixcomposieten zijn geboren

- Met terbium (III) gedoteerd fluorescerend glas voor biomedisch onderzoek
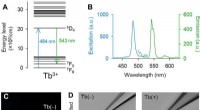
- Door schimmels geproduceerd pigment is veelbelovend als halfgeleidermateriaal

- Apparaat kan ziekte horen door structuren waarin cellen zijn ondergebracht

- Nieuwe manier om het elektrische dubbellaagse effect te onderzoeken
 Voorspelbaarheidslimiet voor tropische cyclonen boven de westelijke noordelijke Stille Oceaan
Voorspelbaarheidslimiet voor tropische cyclonen boven de westelijke noordelijke Stille Oceaan Broeikasgasconcentraties in de atmosfeer bereiken opnieuw een hoogtepunt
Broeikasgasconcentraties in de atmosfeer bereiken opnieuw een hoogtepunt Hoe te testen op calciumhydroxide
Hoe te testen op calciumhydroxide  Afbeelding:Copernicus Sentinel-1 bespioneert Houston vanuit een baan om de aarde
Afbeelding:Copernicus Sentinel-1 bespioneert Houston vanuit een baan om de aarde Bacteriële nanodraden:niet wat we dachten dat ze waren
Bacteriële nanodraden:niet wat we dachten dat ze waren  Hoe schrijf je 0.000035065 in wetenschappelijke notatie?
Hoe schrijf je 0.000035065 in wetenschappelijke notatie?  Ja, mensen putten de hulpbronnen van de aarde uit, maar schattingen van de voetafdruk vertellen niet het volledige verhaal
Ja, mensen putten de hulpbronnen van de aarde uit, maar schattingen van de voetafdruk vertellen niet het volledige verhaal Waarom sommige groenen bruin worden in historische schilderijen
Waarom sommige groenen bruin worden in historische schilderijen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

