
Wetenschap
Hoe worden kationen geproduceerd?
1. Elektronenverlies:
- Atomen hebben een neutrale lading omdat ze een gelijk aantal protonen (positief geladen deeltjes) en elektronen (negatief geladen deeltjes) bevatten.
- Wanneer een atoom een of meer elektronen verliest, wordt het positiever dan het oorspronkelijk was.
- Het aantal protonen blijft hetzelfde, maar het aantal elektronen is nu minder.
2. Ionisatie -energie:
- De hoeveelheid energie die nodig is om een elektron uit een atoom te verwijderen, wordt de ionisatie -energie genoemd.
- Hoe gemakkelijker het is om een elektron te verwijderen, hoe lager de ionisatie -energie.
- Atomen met lagere ionisatie -energieën vormen eerder kationen.
3. Voorbeelden:
- Natrium (NA): Natrium heeft één elektron in zijn buitenste schaal. Het verliest gemakkelijk dit elektron om een natriumkation (Na +) te worden met een +1 lading.
- magnesium (mg): Magnesium heeft twee elektronen in de buitenste schaal. Het verliest beide elektronen om een magnesiumkation (Mg2 +) te worden met een +2 lading.
- aluminium (AL): Aluminium heeft drie elektronen in de buitenste schaal. Het verliest alle drie elektronen om een aluminium kation (AL3 +) te worden met een +3 lading.
4. Factoren die de vorming van kationen beïnvloeden:
- Elektronenconfiguratie: Atomen met een of twee elektronen in hun buitenste schaal hebben de neiging elektronen te verliezen en kationen te vormen.
- Electro -negativiteit: Atomen met lagere elektronegativiteit (wat betekent dat ze niet zo sterk elektronen aantrekken) hebben meer kans om kationen te vormen.
- Metallic Character: Metalen verliezen de neiging elektronen te verliezen en kationen te vormen.
Samenvattend worden kationen geproduceerd wanneer een atoom een of meer elektronen verliest en positief wordt geladen vanwege de onbalans tussen protonen en elektronen.
 Voedselverspilling:het grootste verlies kan zijn wat je in je mond stopt
Voedselverspilling:het grootste verlies kan zijn wat je in je mond stopt De luchtkwaliteitsambtenaren van SoCal hebben niets ondernomen om de havenvervuiling terug te dringen:in plaats daarvan zijn ze naar een woestijnresort ontsnapt
De luchtkwaliteitsambtenaren van SoCal hebben niets ondernomen om de havenvervuiling terug te dringen:in plaats daarvan zijn ze naar een woestijnresort ontsnapt  Hoe een Amerikaans erfgoed van wilde dieren te beschermen
Hoe een Amerikaans erfgoed van wilde dieren te beschermen  Niet te laat om op hol geslagen klimaatverandering te voorkomen:EU
Niet te laat om op hol geslagen klimaatverandering te voorkomen:EU Bodemgezondheid verbeterd door toevoeging van kleine granen en grasland aan rotaties
Bodemgezondheid verbeterd door toevoeging van kleine granen en grasland aan rotaties
Hoofdlijnen
- Welk ander proces van wetenschappelijke methode om vragen te beantwoorden?
- Variatie in de manier waarop dieren en bacteriën heem gebruiken, onthult een potentieel doelwit voor nieuwe antibiotica
- Naar welk lichaamssysteem behoort de keel?
- Waarom 'democratie door afschrikking' in de Verenigde Staten zou kunnen verzwakken
- Nieuw onderzoek onthult de enige tuimelaars in Engeland
- Hoe enzymen werken:UB-chemici publiceren een belangrijke ontdekking
- Wat zijn de zes menselijke levensprocessen?
- Studie werpt nieuw licht op de manier waarop Schotse bevers omgaan met het milieu
- Wanneer ziektekiemen het lichaam binnengaan, wat zijn antilichamen geproduceerd door?
- Massaspectrometrietechniek helpt bij het identificeren van vervalste manuscripten van Robert Burns

- Chocoladevingerafdrukken kunnen de beweringen op het etiket bevestigen

- Een kunstmatig blad gemaakt van halfgeleidende polymeren
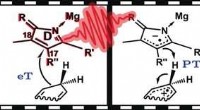
- Stapsgewijze hydrideoverdracht in de biosynthese van chlorofyl
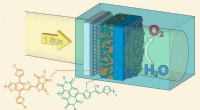
- Recyclebaar bioplastic membraan om olievlekken uit water te verwijderen

 Kooldioxide omzetten in methaan met behulp van ijzer en zonlicht
Kooldioxide omzetten in methaan met behulp van ijzer en zonlicht Wetenschappers vinden bloedmolecuul dat wolven aantrekt stoot mensen af
Wetenschappers vinden bloedmolecuul dat wolven aantrekt stoot mensen af Te midden van pandemie, Eilanden in de Stille Oceaan werken om voedseltekorten te compenseren
Te midden van pandemie, Eilanden in de Stille Oceaan werken om voedseltekorten te compenseren Stropers richten zich op Afrikaanse leeuwen, gieren met vergif
Stropers richten zich op Afrikaanse leeuwen, gieren met vergif Grasdeskundigen leggen uit waarom het mulchen van bladeren een betere oplossing is dan weggooien
Grasdeskundigen leggen uit waarom het mulchen van bladeren een betere oplossing is dan weggooien  Luchteilanden:metafoor of verkeerde benaming?
Luchteilanden:metafoor of verkeerde benaming?  Nieuwe methode gebruikt fluorescentie om ziekteverwekkende vormen van eiwitten te identificeren
Nieuwe methode gebruikt fluorescentie om ziekteverwekkende vormen van eiwitten te identificeren Wat betekent NB onder binding?
Wat betekent NB onder binding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

