
Wetenschap
Welk type binding heeft het grootste verschil in elektronegativiteit?
Dit is waarom:
* elektronegativiteit: Elektronegativiteit is een maat voor het vermogen van een atoom om elektronen in een binding aan te trekken.
* ionische bindingen: Ionische bindingen vormen zich tussen atomen met een groot verschil in elektronegativiteit (meestal groter dan 1,7). Het meer elektronegatief atoom steelt het elektron effectief van het minder elektronegatieve atoom, wat resulteert in de vorming van ionen (geladen deeltjes).
* Covalente bindingen: Covalente bindingen vormen zich tussen atomen met vergelijkbare elektronegativiteiten. De elektronen worden gedeeld tussen de atomen, in plaats van overgedragen.
Voorbeeld:
* Natrium (NA) heeft een lage elektronegativiteit, terwijl chloor (CL) een hoge elektronegativiteit heeft. Het verschil in elektronegativiteit is significant, wat leidt tot de vorming van een ionische binding. Het chlooratoom krijgt een elektron om Cl- (chloride-ion) te worden, terwijl natrium een elektron verliest om Na+ (natriumion) te worden.
Laat het me weten als je meer voorbeelden wilt of specifieke soorten obligaties wilt verkennen!
 Hoe communicatie over milieukwesties de politieke kloof kan overbruggen
Hoe communicatie over milieukwesties de politieke kloof kan overbruggen  EarthTalk:Wat zijn enkele goedkope manieren om een huis groen te maken?
EarthTalk:Wat zijn enkele goedkope manieren om een huis groen te maken?  Wetenschappers bestuderen voor het eerst samenstelling van poriewater in methaankoude sijpeling van oostelijke Arctische zeeën
Wetenschappers bestuderen voor het eerst samenstelling van poriewater in methaankoude sijpeling van oostelijke Arctische zeeën De sleutel tot zakelijk succes van groene consumenten begrijpen
De sleutel tot zakelijk succes van groene consumenten begrijpen Japan weegt nog steeds stortplaats radioactief water van Fukushima in oceaan
Japan weegt nog steeds stortplaats radioactief water van Fukushima in oceaan
Hoofdlijnen
- Anticiperen op toekomstige risico's van klimaatgedreven bosbranden in de boreale bossen
- Welke 2 processen worden gebruikt om macromoleculen en voedseldeeltjes door het celmembraan te verplaatsen?
- Welke consumenten eten algen?
- Hoe cellen 'klimmen' om luchtpijpen van fruitvliegjes te bouwen
- Waarom zien mitochondriën eruit zoals ze eruit zien?
- Onderzoeker test de levensduur van C. elegans om te begrijpen hoe de hersenen de leeftijd dicteren
- Waarom zijn er vier verschillende soorten nucleotiden?
- Wat simuleert het plakken van DNA op groot papier?
- Hoe testen wetenschappers hypothesen?
- Materiaal gemaakt van een enkel molecuul vormt zichzelf tot een rooster dat zichzelf kan genezen, gassen opslaan
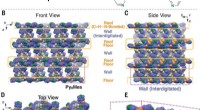
- Onderzoekers die werken aan het terugwinnen van zeldzame aardelementen en het veiligstellen van kritieke materialen voor schone energietechnologieën

- De groei van nanodeeltjes belichten met röntgenstralen

- Onderzoek geeft aan hoe algemene anesthetica en benzo's inwerken op receptoren in de hersenen
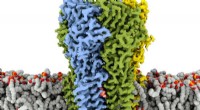
- Tweetalig molecuul verbindt twee basiscodes voor het leven

 Jetstream wordt niet golvender ondanks de opwarming van het noordpoolgebied
Jetstream wordt niet golvender ondanks de opwarming van het noordpoolgebied De duikvlucht in het aantal beursintroducties dit jaar weerspiegelt de 'koude markt', maar is deze aan het ontdooien?
De duikvlucht in het aantal beursintroducties dit jaar weerspiegelt de 'koude markt', maar is deze aan het ontdooien?  Nieuwe fossiele vondst werpt licht op hoe mensen leerden lopen
Nieuwe fossiele vondst werpt licht op hoe mensen leerden lopen  Maïsopbrengsten in de VS krijgen een boost door een gat in de opwarming van de aarde
Maïsopbrengsten in de VS krijgen een boost door een gat in de opwarming van de aarde Spread-veranderende bestellingen en verwijderingen hebben invloed op de aandelenkoersen
Spread-veranderende bestellingen en verwijderingen hebben invloed op de aandelenkoersen Weet jij waarom sterren fonkelen aan de nachtelijke hemel?
Weet jij waarom sterren fonkelen aan de nachtelijke hemel?  Nieuwe selfie toont Curiosity, de chemicus van Mars
Nieuwe selfie toont Curiosity, de chemicus van Mars Hoeveel verschil maakt het aantal kinderen in een klaslokaal?
Hoeveel verschil maakt het aantal kinderen in een klaslokaal?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

