
Wetenschap
Wat is de molariteit van Carborane Superacid?
* Carborane -superacides zijn een klasse zuren, geen enkele verbinding. Er zijn veel verschillende carboranen, elk met zijn unieke structuur en zuurgraad. Enkele veel voorkomende voorbeelden zijn:
* H (CHB11Cl11)
* H (CHB11BR11)
* Molariteit hangt af van de concentratie. Je moet weten hoeveel carborane superacides wordt opgelost in een specifiek volume oplosmiddel om de molariteit te berekenen.
* Carborane -superacides worden vaak gebruikt in zeer verdunde oplossingen. Dit komt omdat ze extreem sterk zijn en corrosief kunnen zijn.
Daarom zou je moeten weten: om de molariteit van een specifieke carborane superacid te vinden, zou je moeten weten:
1. De specifieke carboraanverbinding.
2. De massa van de carborane superacide.
3. Het volume van het oplosmiddel.
Molariteit berekenen:
1. Vind de molaire massa van de carborane superacida.
2. Verdeel de massa van de carboraan -superacide door zijn molaire massa om het aantal mol te vinden.
3. Verdeel het aantal mol door het volume van het oplosmiddel (in liters) om de molariteit te krijgen.
Voorbeeld:
Laten we zeggen dat u 0,5 gram H (CHB11Cl11) hebt opgelost in 100 ml van een oplosmiddel.
1. Molaire massa van H (CHB11Cl11): Ongeveer 362,2 g/mol
2. mol H (CHB11Cl11): 0,5 g / 362,2 g / mol =0,00138 mol
3. Volume van oplosmiddel (in liters): 100 ml =0,1 l
4. Molariteit: 0,00138 mol / 0,1 L =0,0138 m
Belangrijke opmerking: Carborane Superacides zijn extreem sterk en corrosief. Behandel ze altijd met extreme voorzichtigheid en geschikte veiligheidsuitrusting.
 Maïsvelden kunnen een rol spelen bij het recyclen van oude elektronica
Maïsvelden kunnen een rol spelen bij het recyclen van oude elektronica Nieuwe materialen:Briljant wit zonder pigmenten
Nieuwe materialen:Briljant wit zonder pigmenten Is het gunstig om alkalieën te gebruiken bij de behandeling van hyperzuurgraad, ongeacht exotherme reactie?
Is het gunstig om alkalieën te gebruiken bij de behandeling van hyperzuurgraad, ongeacht exotherme reactie?  Een nieuw op polyethyleen-B4C gebaseerd beton voor afscherming
Een nieuw op polyethyleen-B4C gebaseerd beton voor afscherming Wetenschappers ontdekken hoe oppervlakken het vroege leven op aarde hebben kunnen helpen beginnen
Wetenschappers ontdekken hoe oppervlakken het vroege leven op aarde hebben kunnen helpen beginnen
 Los Angeles en Google werken samen aan Tree Canopy-project
Los Angeles en Google werken samen aan Tree Canopy-project Afrikaanse landen doen niet genoeg om zich voor te bereiden op stijgende zeespiegel
Afrikaanse landen doen niet genoeg om zich voor te bereiden op stijgende zeespiegel Hongkong hitterecord september twee keer gebroken
Hongkong hitterecord september twee keer gebroken VN-klimaatchef:toezeggingen van grote vervuilers versterken de hoop van Parijs
VN-klimaatchef:toezeggingen van grote vervuilers versterken de hoop van Parijs Voedsel FOMO draagt bij aan voedselverspilling van generatie Z
Voedsel FOMO draagt bij aan voedselverspilling van generatie Z
Hoofdlijnen
- Huistuinen zijn levende genenbanken die het levensonderhoud in Centraal-Azië ondersteunen
- Rijd naar gigantisch nieuw zeereservaat op Antarctica
- Hoe microben de zoektocht naar buitenaards leven kunnen ondersteunen
- Welke leden van de Phyla -specie zijn parasieten mensen?
- Welke stap van de wetenschappelijke methode omvat het identificeren van variabelen?
- Welke woorden kunt u gebruiken om een hypothese te vormen?
- Drie nieuwe soorten grondslangen ontdekt onder kerkhoven en kerken in Ecuador
- Wie heeft er baat bij menselijke experimenten?
- Verschillende soorten enzymen
- Moleculaire schakelaar maakt fotomechanisch springen van polymeren mogelijk
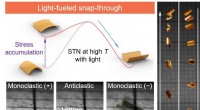
- Onderzoek effent de weg voor de volgende generatie kristallijne materiaalzeefapparatuur

- Nieuwe klasse zachte halfgeleiders kan HD-schermen transformeren
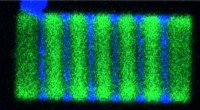
- Onderzoek levert doorbraken op in het begrijpen van falen van hoogwaardige vezels

- Nieuwe methode maakt efficiënte monstervoorbereiding voor eencellige proteomics mogelijk

 Welk cross -vallei -profiel is typerend voor canyons en valleien geërodeerd door alpine of gletsjers?
Welk cross -vallei -profiel is typerend voor canyons en valleien geërodeerd door alpine of gletsjers?  Poriëndrukdiffusie leidde tot microseismiciteit op de koolstofvastleggingslocatie in het Illinois-bekken, zo blijkt uit modelstudies
Poriëndrukdiffusie leidde tot microseismiciteit op de koolstofvastleggingslocatie in het Illinois-bekken, zo blijkt uit modelstudies  Terwijl Aziatische steden zinken, beheerde retraite moet worden ingediend
Terwijl Aziatische steden zinken, beheerde retraite moet worden ingediend NASA levert laser voor LISA-missie
NASA levert laser voor LISA-missie Hoe zijn de verschillende secties van het periodieke tabel dat wordt genoemd?
Hoe zijn de verschillende secties van het periodieke tabel dat wordt genoemd?  Welke twee mensen worden gecrediteerd voor het ontdekken van de vorm van DNA?
Welke twee mensen worden gecrediteerd voor het ontdekken van de vorm van DNA?  Stroomstoring:Een verlies aan sociale macht verstoort de manier waarop geld wordt weergegeven
Stroomstoring:Een verlies aan sociale macht verstoort de manier waarop geld wordt weergegeven  Greenpeace:een waanzinnig visioen dat 50 jaar geleden een vlucht nam
Greenpeace:een waanzinnig visioen dat 50 jaar geleden een vlucht nam
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

