
Wetenschap
Hoeveel mol ammoniak ontstaat als 6 mol waterstofgas reageert met een overmaat stikstofgas?
De uitgebalanceerde chemische vergelijking voor de reactie is:
$$3H_2(g) + N_2(g) \pijl naar rechts 2NH_3(g)$$
Volgens de stoichiometrie van de reactie reageren 3 mol waterstofgas met 1 mol stikstofgas, waarbij 2 mol ammoniak ontstaat. Als 6 mol waterstofgas reageert, kan het aantal geproduceerde mol ammoniak als volgt worden berekend:
$$6 mol H_2 \times \frac{2 mol NH_3}{3 mol H_2} =4 mol NH_3$$
Er ontstaat dus 4 mol ammoniak als 6 mol waterstofgas reageert met een overmaat stikstofgas.
Hoofdlijnen
- Van blad tot kopje:het ontcijferen van de biochemische dans van de geur van zwarte thee
- Unieke pigmenten in de fotosynthetische mariene bacterie onthullen hoe hij leeft bij weinig licht
- Hoe herhaalbaar is de evolutionaire geschiedenis?
- Het menselijk genoomproject heeft de sequentie van basenparen in zijn geheel bepaald. Hoe heeft dit een directe invloed op ons begrip van genetische ziekten?
- Onderzoekers brachten twee jaar door in diepe ondergrondse grotten om dit buitengewone fossiel aan het licht te brengen
- Toenemend bewijs dat beren geen carnivoren zijn
- Waarom hebben zoveel van onze huisdieren overgewicht?
- Welke microscoop zou je gebruiken om een levende amoebe te observeren?
- Een kudde flamingo's geeft hoop:zijn de zeldzame vogels voorgoed teruggekeerd naar de Everglades?
- Nieuwe enzymvrije strategie om organofosforresiduen van pesticiden te detecteren

- Uitvinding aangewakkerd door COVID-19-pandemie desinfecteert continu veilig oppervlakken

- Chemici ontwikkelen een methode om verbindingen voor geneesmiddelen te synthetiseren
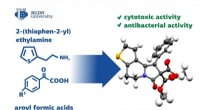
- Nieuwe methode zou kunnen helpen om zuiverder, veiligere medicijnen

- Door SwRI ontwikkeld mobiel systeem om gevaarlijke chemische oorlogsmiddelen ter plaatse te vernietigen

 Hoe hergebruik je zelfklevende thermometers?
Hoe hergebruik je zelfklevende thermometers?  Wat is geen groot idee waarbij kracht en beweging betrokken zijn?
Wat is geen groot idee waarbij kracht en beweging betrokken zijn?  Smeltende gletsjer op Kamtsjatka droeg bij aan zeestijging
Smeltende gletsjer op Kamtsjatka droeg bij aan zeestijging Waarom de vulkaan Mount Nyiragongo uitbarstte zonder enige waarschuwing
Waarom de vulkaan Mount Nyiragongo uitbarstte zonder enige waarschuwing Niet alle onderbrekingen zijn slecht:hoe verrassende pauzes de creativiteit op het werk kunnen ontketenen
Niet alle onderbrekingen zijn slecht:hoe verrassende pauzes de creativiteit op het werk kunnen ontketenen  COVID-leerverlies meten
COVID-leerverlies meten Op welke twee manieren worden waterbiomen geclassificeerd?
Op welke twee manieren worden waterbiomen geclassificeerd?  In welke vorm bestaat salpeterzuur?
In welke vorm bestaat salpeterzuur?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


