
Wetenschap
Hoe zijn de onderwerpen ionenvorming en periodieke trends met elkaar verbonden?
1. Valentie-elektronen:Het aantal valentie-elektronen bepaalt grotendeels het gemak waarmee een element ionen vormt. Elementen in dezelfde groep (verticale kolom) van het periodiek systeem delen hetzelfde aantal valentie-elektronen. Deze gelijkenis leidt tot vergelijkbare ionisatiepatronen.
2. Ionisatie-energie:Ionisatie-energie is de energie die nodig is om een elektron uit een neutraal atoom te verwijderen. Elementen met lage ionisatie-energieën hebben de neiging gemakkelijk elektronen te verliezen en positieve ionen (kationen) te vormen. Naarmate je lager in een groep komt, neemt de ionisatie-energie over het algemeen af omdat het gemakkelijker wordt om een elektron uit de buitenste schil te verwijderen.
3. Elektronegativiteit:Elektronegativiteit meet het vermogen van een atoom om elektronen aan te trekken. Hoe hoger de elektronegativiteit, hoe meer een atoom elektronen naar zich toe trekt. Over een periode (horizontale rij) neemt de elektronegativiteit doorgaans toe van links naar rechts. Elementen met een hoge elektronegativiteit hebben een grotere neiging om elektronen op te nemen en negatieve ionen (anionen) te vormen.
4. Ionische stralen:Ionische straal verwijst naar de grootte van een ion. Kationen zijn doorgaans kleiner dan hun neutrale tegenhangers vanwege het verlies van elektronen. Anionen daarentegen zijn groter dan hun neutrale atomen omdat ze meer elektronen hebben. De grootte van ionen volgt periodieke trends, waarbij elementen in dezelfde periode vergelijkbare ionenstralen hebben.
5. Stabiliteit van ionen:Periodieke trends helpen ook de stabiliteit van ionen te voorspellen. Over het algemeen zijn ionen met een volledige buitenste elektronenschil (edelgasconfiguratie) het meest stabiel. Alkalimetalen (Groep 1) hebben bijvoorbeeld de neiging hun enkele valentie-elektron te verliezen om een stabiele edelgasconfiguratie te bereiken, waardoor stabiele kationen worden gevormd. Halogenen (Groep 17) krijgen gemakkelijk één elektron om hun buitenste schil te voltooien, wat resulteert in stabiele anionen.
6. Ionenlading:De lading van een ion houdt verband met het aantal gewonnen of verloren elektronen. Elementen in het periodiek systeem hebben de neiging ionen te vormen met een lading die overeenkomt met hun groepsnummer. Elementen in Groep 1 vormen bijvoorbeeld 1+ ionen, terwijl die in Groep 2 2+ ionen vormen.
Door ionenvorming en periodieke trends te begrijpen, kunnen wetenschappers het gedrag van elementen voorspellen, chemische eigenschappen zoals reactiviteit en binding verklaren, en patronen die in het periodiek systeem worden waargenomen, rationaliseren. Het helpt ook bij het ontwerpen van materialen met specifieke eigenschappen en bij het begrijpen van chemische reacties op een fundamenteel niveau.
 Onderzoekers ontwerpen sensoren om plantenhormonen snel te detecteren
Onderzoekers ontwerpen sensoren om plantenhormonen snel te detecteren Chemici bouwen natuurlijke antikankerverbinding met efficiënt nieuw proces
Chemici bouwen natuurlijke antikankerverbinding met efficiënt nieuw proces Zirkonium gebruiken als additief in supersterke composietmaterialen
Zirkonium gebruiken als additief in supersterke composietmaterialen Supramoleculaire materialen met een tijdschakelaar
Supramoleculaire materialen met een tijdschakelaar UV-waarnemend eiwit in de hersenen van zoöplankton marien annelid
UV-waarnemend eiwit in de hersenen van zoöplankton marien annelid
 Honderden geëvacueerd nadat angstaanjagende overstromingen Nieuw-Zeeland troffen
Honderden geëvacueerd nadat angstaanjagende overstromingen Nieuw-Zeeland troffen Het vervangen van sommige oude leidingen kan nog steeds leiden tot met lood verontreinigd water
Het vervangen van sommige oude leidingen kan nog steeds leiden tot met lood verontreinigd water Ooit gehoord van het Maritieme Continent? Het ligt niet ver van Australië en kanaliseert warmte over de hele wereld
Ooit gehoord van het Maritieme Continent? Het ligt niet ver van Australië en kanaliseert warmte over de hele wereld  Welke soorten voedsel doen eekhoorns?
Welke soorten voedsel doen eekhoorns?  Hoe 's werelds legers hun enorme koolstof-emissies verbergen
Hoe 's werelds legers hun enorme koolstof-emissies verbergen
Hoofdlijnen
- Waarom het zo goed voelt om bang te zijn
- Het vastleggen van circulerende kankercellen zou inzicht kunnen verschaffen in de manier waarop ziekten zich verspreiden
- Wat was er eerst:twee- of driecellig stuifmeel? Nieuw onderzoek actualiseert een klassiek debat
- Waarom gebruiken cellen GTP in plaats van ATP bij celsignalering?
- Hoe worden chemische signalen door het celmembraan overgedragen?
- Wil je gezond eten en de planeet redden? Vervang rundvlees door Spirulina-algen, zeggen onderzoekers
- Bacteriën met synthetisch gencircuit zelf-assembleren om werkend apparaat te bouwen met gouden nanodeeltjes
- Onderzoekers onderzoeken hoe de eiwitfabrieken van een cel in elkaar worden gezet
- Nee,
- Het toevoegen van koper versterkt 3D-geprint titanium

- Machine learning voorspelde een superhard wolfraamnitride met hoge energiedichtheid
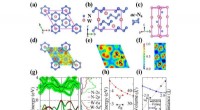
- Het ontwerpen van een vrijstaande, supercharged polypeptide protongeleidend membraan
- Nieuw boormateriaal met hoge hardheid gecreëerd door chemische dampafzetting in plasma

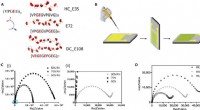
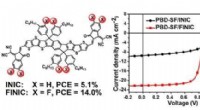
- Onderzoekers ontwikkelen elektronenacceptor met gefuseerde ring met 3D-exciton en ladingstransport
 De luchtkwaliteit op veel treinstations is alarmerend slecht. Hier leest u hoe u deze kunt verbeteren
De luchtkwaliteit op veel treinstations is alarmerend slecht. Hier leest u hoe u deze kunt verbeteren  Studie vindt dat mensen wind en weer direct beïnvloeden boven de Noord-Atlantische Oceaan
Studie vindt dat mensen wind en weer direct beïnvloeden boven de Noord-Atlantische Oceaan Hematiet,
Hematiet,  Onderzoekers die ultraviolette lasers gebruiken, maken ongekende metingen van nanomaterialen
Onderzoekers die ultraviolette lasers gebruiken, maken ongekende metingen van nanomaterialen Vogelgriep treft Zuid-Afrika bedreigde pinguïns
Vogelgriep treft Zuid-Afrika bedreigde pinguïns Spin-current generatie krijgt mid-infrarood boost met plasmonisch metamateriaal
Spin-current generatie krijgt mid-infrarood boost met plasmonisch metamateriaal Ultraviolet om ultradun te produceren in nieuwe financiering
Ultraviolet om ultradun te produceren in nieuwe financiering Meer dan 90% van het gletsjervolume in de Alpen zou tegen 2100 . verloren kunnen gaan
Meer dan 90% van het gletsjervolume in de Alpen zou tegen 2100 . verloren kunnen gaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

