
Wetenschap
Waarom heeft gas druk?
De druk van een gas is recht evenredig met de temperatuur en omgekeerd evenredig met het volume. Dit betekent dat naarmate de temperatuur van een gas stijgt, de druk ook toeneemt. Op dezelfde manier zal, naarmate het volume van een gas toeneemt, de druk ervan afnemen.
De relatie tussen druk, temperatuur en volume van een gas kan wiskundig worden uitgedrukt met behulp van de ideale gaswet:
```
PV =nRT
```
Waar:
- P is de druk van het gas
- V is het volume van het gas
- n is het aantal mol gas
- R is de universele gasconstante
- T is de temperatuur van het gas
De ideale gaswet laat zien dat de druk van een gas recht evenredig is met de temperatuur en omgekeerd evenredig met het volume.
 Hoe de opwarming van de aarde bijdraagt aan de gezondheidsrisico's van arme mensen
Hoe de opwarming van de aarde bijdraagt aan de gezondheidsrisico's van arme mensen Onderzoeksreis om de impact van een gigantische drijvende ijsberg te bestuderen
Onderzoeksreis om de impact van een gigantische drijvende ijsberg te bestuderen Positieve effecten van mensen op het ecosysteem
Positieve effecten van mensen op het ecosysteem  Welke invloed hebben ijsbergen op hun omgeving?
Welke invloed hebben ijsbergen op hun omgeving?  De levenscyclus van planten voor kinderen
De levenscyclus van planten voor kinderen
Hoofdlijnen
- Begrijpen hoe microbiota gedijen in hun menselijke gastheren
- Geen bewijs dat het onthoornen van zwarte neushoorns een negatieve invloed heeft op de voortplanting of overleving van de soort, studievondsten
- Hoeveel cellen zijn er in het menselijk lichaam?
- 10 misvattingen over de griep
- Wetenschappers creëren een nieuwe functionele morfologie-index om te begrijpen hoe voorouders van moderne vogels hun vleugels gebruikten
- Wat is vijver? Onderzoek levert eerste datagestuurde definitie op
- Computers verklaren waarom peren bruin kunnen worden tijdens commerciële opslag
- Onderzoek onthult de verdeling van de bloemenvoorraden onder naast elkaar bestaande hommels op soort-, kolonie- en individueel niveau
- Wat gebeurt er als weefsel wordt aangevallen door een virus?
- Nieuwe modellen om de microstructuur van polymeermengsels te onderzoeken

- Het leren van chemische netwerken geeft het leven een chirale draai

- Massaspectrometrietechniek helpt bij het identificeren van vervalste manuscripten van Robert Burns

- Een nieuwe strategie voor de synthese van complexe natuurlijke producten
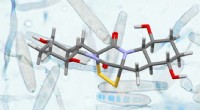
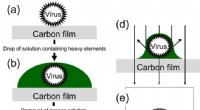
- Nieuw niet-radioactief, neutraal reagens onthult virussen in duidelijke details
 AX J1910.7+0917 is de langzaamste röntgenpulsar, studie vondsten
AX J1910.7+0917 is de langzaamste röntgenpulsar, studie vondsten Wolven uit de wildernis roepen. Zal uw hond antwoorden?
Wolven uit de wildernis roepen. Zal uw hond antwoorden?  Vergeet ons toekomstige klimaat niet bij het aanscherpen van bouwvoorschriften
Vergeet ons toekomstige klimaat niet bij het aanscherpen van bouwvoorschriften Hoe kunstmatige intelligentie de economische theorie verandert
Hoe kunstmatige intelligentie de economische theorie verandert  Ontwerp, synthese en toepassingen van functionele metaal-organische raamwerken op basis van zirkonium
Ontwerp, synthese en toepassingen van functionele metaal-organische raamwerken op basis van zirkonium  Post-pandemisch werk in de publieke sector:een nieuwe weg vooruit of een terugkeer naar het verleden?
Post-pandemisch werk in de publieke sector:een nieuwe weg vooruit of een terugkeer naar het verleden?  De omvang van het zee-ijs zakt naar recorddiepten aan beide polen
De omvang van het zee-ijs zakt naar recorddiepten aan beide polen Onderzoek wijst op valkuilen bij cybervetting van sollicitanten
Onderzoek wijst op valkuilen bij cybervetting van sollicitanten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

