
Wetenschap
Wat is het probleem voor suiker en zout bij het vriespunt van water?
Wanneer we suiker of zout aan water toevoegen, daalt het vriespunt van water. Dit komt omdat de opgeloste deeltjes (suiker- of zoutmoleculen) de vorming van ijskristallen verstoren. Om water te laten bevriezen, moeten watermoleculen vrij kunnen bewegen en een kristallijne structuur kunnen vormen. Wanneer er echter opgeloste deeltjes aanwezig zijn, zitten ze de watermoleculen in de weg en voorkomen ze dat ze kristallen vormen. Dit betekent dat het water moet worden gekoeld tot een lagere temperatuur om te kunnen bevriezen.
De mate waarin het vriespunt daalt, is afhankelijk van de concentratie van de oplossing. Hoe meer opgeloste deeltjes er zijn, hoe lager het vriespunt zal zijn.
Dit fenomeen is belangrijk in een aantal toepassingen, zoals:
* Voedsel bewaren . Suiker en zout worden vaak gebruikt om voedsel te conserveren, omdat ze voorkomen dat het bevriest en bederft.
* Wegen ontdooien . Zout wordt gebruikt om wegen en trottoirs te ontdooien, omdat het het vriespunt van water verlaagt en het smelten van ijs gemakkelijker maakt.
* Voorkomen van vorstschade . Suiker en zout kunnen worden gebruikt om vorstschade aan planten te voorkomen door ze vóór de vorst op de planten te spuiten.
Het is belangrijk op te merken dat het vriespunt van water niet het enige is dat wordt beïnvloed door de aanwezigheid van opgeloste deeltjes. Het kookpunt van water neemt ook toe als opgeloste deeltjes aanwezig zijn.
 Nucleair afval stapelt zich op:regeringen moeten stoppen met aarzelen en actie ondernemen
Nucleair afval stapelt zich op:regeringen moeten stoppen met aarzelen en actie ondernemen Ziektedragende muggen zeldzaam in ongestoorde tropische bossen
Ziektedragende muggen zeldzaam in ongestoorde tropische bossen De olie- en gasindustrie liegt al tientallen jaren over de opwarming van de aarde – het is al lang geleden dat er verantwoording moet worden afgelegd
De olie- en gasindustrie liegt al tientallen jaren over de opwarming van de aarde – het is al lang geleden dat er verantwoording moet worden afgelegd  Saint-Tropez ruimt op na olieramp in Middellandse Zee
Saint-Tropez ruimt op na olieramp in Middellandse Zee Hoe de zeebodem van de Antarctische Oceaan verandert - en het klimaat volgt dit voorbeeld
Hoe de zeebodem van de Antarctische Oceaan verandert - en het klimaat volgt dit voorbeeld
Hoofdlijnen
- Kun jij een paar haren van een renpaard stelen en je eigen haren klonen?
- Weten waar honden graag naar kijken, kan dierenartsen helpen hun gezichtsvermogen te beoordelen
- Hoe binnenkomende adenovirussen hun chromatinestructuur veranderen voor efficiënte genexpressie
- Hoe je hersenen werken
- Wat zijn de verschillen tussen een plant en een dierlijke cel onder een microscoop?
- Een leider in de Amerikaanse zeewierteelt predikt, onderwijst en bouwt een breder netwerk op
- Het ontsluiten van de geheimen van interacties tussen planten en elektromagnetische velden:een uitgebreid overzicht
- Hoe beïnvloeden wilde varkens oeversystemen?
- Welk type binding houdt 2 strengen DNA bij elkaar?
- Ontgrendelen van efficiënte licht-energieconversie met stabiele coördinatie-nanobladen

- Aceton plus licht creëert een groen additief voor vliegtuigbrandstof

- Hoogwaardig elektrodensysteem met groot oppervlak, ontwikkeld voor kunstmatige fotosynthese

- Koolhydraten vastleggen
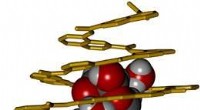
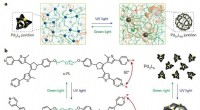
- Lichtgestuurde polymeren kunnen wisselen tussen stevig en zacht
 Hoe buitenaardse wezens werken
Hoe buitenaardse wezens werken  Nieuwe chemische methode maakt het gemakkelijker om vervuilende pesticiden uit water te halen
Nieuwe chemische methode maakt het gemakkelijker om vervuilende pesticiden uit water te halen Actief zeven kan dialyse- en waterzuiveringsfilters verbeteren
Actief zeven kan dialyse- en waterzuiveringsfilters verbeteren Is het olielek gedicht? Wat we weten over de oorsprong van de enorme lekkage in Orange County
Is het olielek gedicht? Wat we weten over de oorsprong van de enorme lekkage in Orange County  Dual-purpose film voor energieopslag, waterstofkatalyse:scheikundigen krijgen voorsprong in energie van de volgende generatie
Dual-purpose film voor energieopslag, waterstofkatalyse:scheikundigen krijgen voorsprong in energie van de volgende generatie Russisch vliegtuig in dodelijk vuur vond wereldwijd weinig klanten
Russisch vliegtuig in dodelijk vuur vond wereldwijd weinig klanten Je ware zelf zijn wordt niet altijd gelijk behandeld in de zakenwereld, nieuwe studie vondsten
Je ware zelf zijn wordt niet altijd gelijk behandeld in de zakenwereld, nieuwe studie vondsten Productiesubsidies:het geheim van het succes van China?
Productiesubsidies:het geheim van het succes van China?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

