
Wetenschap
Welk volume stikstof bij 215 C en 715 mmHg zou nodig zijn om te reageren met 0,1 mol waterstof en ammoniak te produceren?
De uitgebalanceerde chemische vergelijking voor de reactie is:
$$N_2 + 3H_2 \pijl naar rechts 2NH_3$$
Volgens de vergelijking reageert 1 mol stikstof met 3 mol waterstof. Daarom vereist 0,1 mol waterstof 1/3 mol stikstof om een volledige reactie te bereiken.
Gebruikmakend van de ideale gaswet:$$PV =nRT$$ waarbij P de druk is, V het volume, n het aantal mol is, R de ideale gasconstante is en T de temperatuur is.
We kunnen de vergelijking herschikken om het stikstofvolume te berekenen:$$V =\frac{nRT}{P}$$
Gegeven:
- Temperatuur, $$T =215 °C + 273 =488 K$$ (Celsius omrekenen naar Kelvin)
- Druk, $$P =715 mmHg =715/760 =0,941 atm (mmHg omzetten naar atm)$$
- Aantal mol stikstof, $$n =\frac{1}{3} \times 0,1 =0,033 mol$$
- Gasconstante, $$R =0,08206 L * atm / mol * K$$
De waarden invoeren:$$V =\frac{(0,033 mol) \times (0,08206 L * atm / mol * K) \times (488 K)}{0,941 atm}$$ $$V \circa 1,14 L$$
Daarom zou er ongeveer 1,14 liter stikstof bij 215 °C en 715 mmHg nodig zijn om te reageren met 0,1 mol waterstof en ammoniak te produceren.
 Kan interstellair ijs het antwoord bieden op de geboorte van DNA?
Kan interstellair ijs het antwoord bieden op de geboorte van DNA? Zelf-assemblerende eiwitfilamenten die helemaal opnieuw zijn ontworpen en gebouwd
Zelf-assemblerende eiwitfilamenten die helemaal opnieuw zijn ontworpen en gebouwd Wat is de formule van de ionische verbinding gevormd door magnesium- en fosforatomen?
Wat is de formule van de ionische verbinding gevormd door magnesium- en fosforatomen?  Nikkelchloride zilvernitraat moleculair ionisch en netto ionisch?
Nikkelchloride zilvernitraat moleculair ionisch en netto ionisch?  Waarom goud-palladiumlegeringen beter zijn dan palladium voor waterstofopslag
Waarom goud-palladiumlegeringen beter zijn dan palladium voor waterstofopslag
 Nieuwe bedreiging voor het Victoriameer?
Nieuwe bedreiging voor het Victoriameer?  Onderzoekers traceren de geologische oorsprong van het succes van het superbassin in de Golf van Mexico
Onderzoekers traceren de geologische oorsprong van het succes van het superbassin in de Golf van Mexico Amazones hoogste boom beschermd tegen branden, zeggen wetenschappers
Amazones hoogste boom beschermd tegen branden, zeggen wetenschappers VN waarschuwt voor stijgende e-waste, weinig recycling
VN waarschuwt voor stijgende e-waste, weinig recycling Het vroegste leven kan zijn ontstaan in vijvers, geen oceanen
Het vroegste leven kan zijn ontstaan in vijvers, geen oceanen
Hoofdlijnen
- Arabische gom van de Afrikaanse acaciabomen in de Sahel wordt in honderden producten gebruikt:wat is het waard om te weten
- Welke materialen kan ik gebruiken om een DNA-model te maken?
- Welk celtype is de geleidende cel van het zenuwstelsel?
- Wat is de buitenste laag van een menselijke rode bloedcel?
- Welke 2 systemen controleren de homeostase?
- Zouden mensen bereid zijn hun persoonsgegevens af te staan voor onderzoek?
- Procedures voor elektroforese van gel
- Schildpad die vislijn heeft ingeslikt, losgelaten in oceaan
- Effecten van mobiele telefoons op studenten
- Een vlucht langs de bloed-hersenbarrière maken voor medicijnafgifte
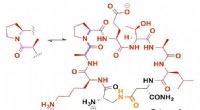
- Elektronenkristallografie bleek net zo goed te werken als röntgenkristallografie alleen op kleinere kristallen

- Nieuwe katalysebenadering reduceert koolstofdioxide tot methaan

- Onderzoekers ontwikkelen 's werelds eerste alcoholische drank gemaakt van tofu-wei

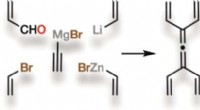
- Gespannen, symmetrisch, en nieuw:tetravinylalleen, een klein maar krachtig molecuul, is voor het eerst gesynthetiseerd
 Luchtverkeersleiding voor auto's zonder bestuurder kan de implementatie versnellen
Luchtverkeersleiding voor auto's zonder bestuurder kan de implementatie versnellen Kun je twee organellen noemen die zich in een plantencel bevinden, maar niet in een dierlijke cel?
Kun je twee organellen noemen die zich in een plantencel bevinden, maar niet in een dierlijke cel?  Hoe SWL-hefpunten te berekenen
Hoe SWL-hefpunten te berekenen  Hoe kunnen elektronen in een vaste stof bewegen?
Hoe kunnen elektronen in een vaste stof bewegen?  Cyberbeveiliging van geconnecteerde autonome voertuigen getest
Cyberbeveiliging van geconnecteerde autonome voertuigen getest Verbetering van de werkzaamheid van immuniteitsactiverende nucleïnezuurgeneesmiddelen
Verbetering van de werkzaamheid van immuniteitsactiverende nucleïnezuurgeneesmiddelen Onderzoekers beoordelen waterveiligheid van Centraal-Aziatische landen
Onderzoekers beoordelen waterveiligheid van Centraal-Aziatische landen Wat Microsoft niet zei over Windows 10 is belangrijk om te weten
Wat Microsoft niet zei over Windows 10 is belangrijk om te weten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

