
Wetenschap
Wat betekent de term overmaat in de chemie?
Beschouw bijvoorbeeld de reactie tussen waterstof en zuurstof om water te vormen:
2H2 + O2 → 2H2O
Bij deze reactie zijn voor elke mol zuurstof (O2) 2 mol waterstof (H2) nodig. Als we beginnen met 4 mol waterstof en 2 mol zuurstof, hebben we 2 mol overtollige waterstof. Dit betekent dat er wat waterstof overblijft nadat de reactie voltooid is.
De aanwezigheid van overtollige reactanten kan om verschillende redenen belangrijk zijn bij bepaalde chemische reacties:
1. Om de reactie tot voltooiing te brengen:In sommige gevallen kan het gebruik van een overmaat van één reactant de reactie tot voltooiing brengen. Bij de reactie van waterstof en zuurstof zorgt een overmaat aan waterstof er bijvoorbeeld voor dat alle zuurstof wordt verbruikt, waardoor de vorming van water wordt gemaximaliseerd.
2. Om nevenreacties te minimaliseren:Overtollige reactanten kunnen soms ongewenste nevenreacties onderdrukken. Bij complexe reacties met meerdere mogelijke routes kan de overmaat van één reactant bij voorkeur de gewenste reactie aansturen, waardoor de kans op nevenreacties wordt verkleind.
3. Om de productopbrengst te optimaliseren:Een overmaat van een bepaalde reactant kan de opbrengst van het gewenste product verhogen. Dit is vooral belangrijk in industriële processen waar het maximaliseren van de productoutput cruciaal is.
4. Om de reactiesnelheid te controleren:Bij bepaalde reacties kunnen overtollige reactanten worden gebruikt om de reactiesnelheid te controleren. Door de hoeveelheid overtollige reactant te variëren, kan de reactiesnelheid worden aangepast om de gewenste resultaten te bereiken.
Het is vermeldenswaard dat het gebruik van een overmaat aan reactanten ook nadelen kan hebben, zoals hogere productiekosten, potentiële veiligheidsrisico's als gevolg van een teveel aan reactanten en de noodzaak om overtollige reactanten na de reactie te scheiden of te verwijderen. Daarom moet het gebruik van overtollige reactanten zorgvuldig worden overwogen en geoptimaliseerd op basis van de specifieke reactie en de vereisten ervan.
 Wat is een chemische reactie met een zuurbase?
Wat is een chemische reactie met een zuurbase?  Ingenieurs maken slimme aerogel die lucht in drinkwater verandert
Ingenieurs maken slimme aerogel die lucht in drinkwater verandert Onderzoekers vinden een manier om het hele spectrum van zonlicht te benutten
Onderzoekers vinden een manier om het hele spectrum van zonlicht te benutten Giftige chemicaliën uit water verwijderen:nieuwe milieuvriendelijke methode
Giftige chemicaliën uit water verwijderen:nieuwe milieuvriendelijke methode Wetenschappers ontwikkelen real-time techniek voor het bestuderen van ionische vloeistoffen op elektrode-interfaces
Wetenschappers ontwikkelen real-time techniek voor het bestuderen van ionische vloeistoffen op elektrode-interfaces
Hoofdlijnen
- Wat zijn enkele voorbeelden van niet-aanpassingen?
- Wetenschappers vinden ontbrekende aanwijzing voor de manier waarop HIV-hackcellen zichzelf voortplanten
- Onderzoekers tonen aan dat heparansulfaat de functies van groeifactoreiwitten aanpast
- Hoe de kogelvis aan zijn gekke stekels kwam
- Voorbeelden van archaebacteriën met hun wetenschappelijke naam en classificatie
- Aanwijzingen van ground zero door vogelgriep op melkveebedrijven in de Texas Panhandle
- Agressieve muurhagedis biedt aanwijzingen om de evolutie te begrijpen
- Recombinante DNA-technologie voor vaccinontwikkeling
- Neanderthaler DNA veranderde de manier waarop moderne mensen eruitzien
- Een nieuwe gelelektroforesetechniek voor snelle biomarkerdiagnose via massaspectrometrie

- Unieke pigmenten in fotosynthetische mariene bacterie onthullen hoe het leeft bij weinig licht
- IJsbestendige coating voor grote constructies is afhankelijk van een prachtige demonstratie van mechanica

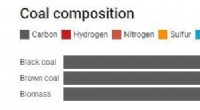
- Hoe maken we waterstof uit steenkool, en is het echt een schone brandstof?
- Ontwikkeling van een ultrasnel biomimetisch snapping hydrogelmateriaal met twee gradiënten
 Zeemeeuwgedrag bij aardbevingen en veranderingen in het weer
Zeemeeuwgedrag bij aardbevingen en veranderingen in het weer  Het gebruik van polynomen
Het gebruik van polynomen De race om bosbranden voor te blijven
De race om bosbranden voor te blijven Wetenschappers verbeteren de fietsprestaties van op Al gebaseerde batterijen met kathode met hoge oppervlaktedichtheid
Wetenschappers verbeteren de fietsprestaties van op Al gebaseerde batterijen met kathode met hoge oppervlaktedichtheid Efficiënte generatie van fotonparen uit gemodificeerde koolstofnanobuisjes
Efficiënte generatie van fotonparen uit gemodificeerde koolstofnanobuisjes De wereld van sociale fenomenen meten
De wereld van sociale fenomenen meten We luisterden naar een Canadese lynx:wat we hoorden was verrassend
We luisterden naar een Canadese lynx:wat we hoorden was verrassend  Enige door dictators geleide landen vormen een verleidelijk doelwit voor bepaalde investeerders
Enige door dictators geleide landen vormen een verleidelijk doelwit voor bepaalde investeerders
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

