
Wetenschap
Hoe maken we waterstof uit steenkool, en is het echt een schone brandstof?

Krediet:het gesprek
Energiegigant AGL heeft deze week plannen onthuld om waterstof te produceren in zijn Loy Yang A-steenkoolstation. Maar hoe transformeren we steenkool, die vaak wordt beschouwd als eenvoudig gemaakt van koolstof, in waterstof – een heel ander element?
In feite, steenkool is niet alleen gemaakt van koolstof. Het bevat ook andere elementen, waarvan er één waterstof is. Maar om veel waterstof te krijgen, de steenkool moet worden "vergast" in plaats van verbrand, het creëren van verbindingen die vervolgens kunnen worden gereageerd met water om waterstof te maken. Hier komt in dit geval het grootste deel van de waterstof vandaan - niet van de steenkool zelf.
Waar wordt steenkool van gemaakt?
In simpele termen, steenkool is een mengsel van twee componenten:op koolstof gebaseerde materie (de vervallen overblijfselen van prehistorische vegetatie) en minerale materie (die afkomstig is van de grond waaruit de steenkool wordt gegraven). De op koolstof gebaseerde materie bestaat uit vijf hoofdelementen:koolstof, waterstof, zuurstof, stikstof en zwavel.
Je kunt het vormingsproces van steenkool zien als een progressie van biomassa (nieuw dood plantaardig materiaal) naar houtskool (bijna pure koolstof). Overuren, de zuurstof en wat waterstof worden geleidelijk verwijderd, steeds meer koolstof achterlatend.
Bruinkool bevat dus iets meer waterstof dan zwarte steenkool, hoewel het grootste verschil tussen de twee het koolstof- en zuurstofgehalte is.
Wat is vergassing?
We kunnen vergassing begrijpen door eerst verbranding te begrijpen. Verbranding, of brandend, is de volledige oxidatie van een brandstof zoals steenkool, een proces dat warmte en koolstofdioxide produceert. Kooldioxide zelf kan niet verder worden geoxideerd, en is dus het onbrandbare eindproduct van het verbrandingsproces.
Bij vergassing, echter, de steenkool is niet volledig geoxideerd. In plaats daarvan, de steenkool wordt omgezet met een verbinding die een vergassingsmiddel wordt genoemd. Vergassing is endotherm, wat betekent dat het geen warmte produceert. Nogal Het tegenovergestelde, in feite - het heeft warmte-inbreng nodig om vooruit te komen. Omdat het resulterende gas niet volledig geoxideerd is, dat betekent dat het zelf als brandstof kan worden verbrand.
Dus hoe maken we waterstof?
Nu kennen we de belangrijkste concepten, laten we weer bij het begin beginnen. Om waterstof te maken uit steenkool, het proces begint met gedeeltelijke oxidatie, wat betekent dat er wat lucht aan de kolen wordt toegevoegd, die kooldioxidegas genereert door middel van traditionele verbranding. Er wordt niet genoeg toegevoegd, Hoewel, om de steenkool volledig te verbranden - alleen genoeg om wat warmte te maken voor de vergassingsreactie. De gedeeltelijke oxidatie maakt ook zijn eigen vergassingsmiddel, kooldioxide.
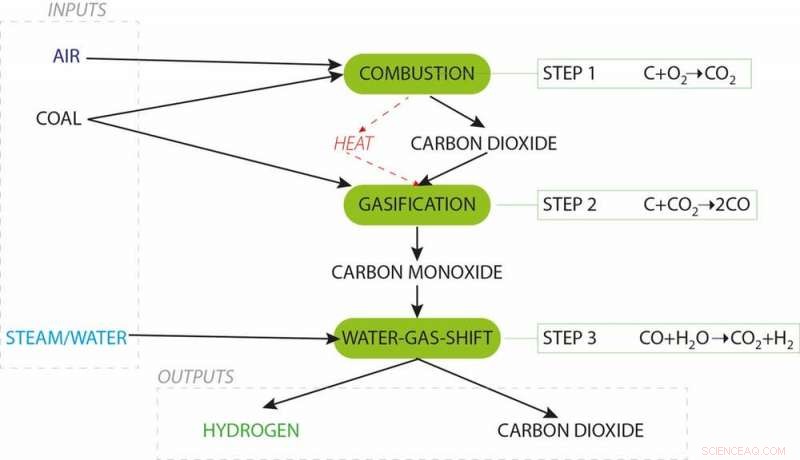
Waterstof maken uit steenkool. Krediet:J. Allen
Kooldioxide reageert met de rest van de koolstof in de steenkool om koolmonoxide te vormen (dit is de endotherme vergassingsreactie, die warmtetoevoer nodig heeft). Nog geen waterstof.
Koolmonoxide in de gasstroom wordt nu verder omgezet met stoom, waterstof en koolstofdioxide genereren. nutsvoorzieningen we maken wat waterstof. De waterstof kan vervolgens door een on-site brandstofcel worden geleid om hoogrenderende elektriciteit op te wekken, hoewel het plan bij Loy Yang A is om de waterstof onder druk te zetten en naar Japan te verschepen voor hun Olympische showcase.
Bruinkool heeft om verschillende redenen over het algemeen de voorkeur voor vergassing boven zwarte kolen, waardoor de bruinkool van Victoria's Latrobe Valley een goed vooruitzicht is voor dit proces.
De belangrijkste reden is dat, vanwege het hoge zuurstofgehalte van dit type steenkool, het is chemisch minder stabiel en daardoor gemakkelijker uit elkaar te vallen tijdens de vergassingsreactie. Bovendien is er een kleine boost van de waterstof die al in de kolen aanwezig is.
Op deze manier geproduceerde waterstof is geen emissievrije brandstof. Kooldioxide wordt uitgestoten door de verbrandings- en thermische ontledingsreacties, en is ook een product van de reactie tussen koolmonoxide en water om waterstof en kooldioxide te maken.
Dus waarom de moeite nemen om waterstof te maken?
Als waterstof als brandstof wordt gebruikt, het geeft alleen water af als bijproduct. Dit maakt het een emissievrije schone brandstof, tenminste op het punt van gebruik.
Het produceren van waterstof uit steenkool in een grote, centrale faciliteit betekent dat verontreinigingsbeheersing kan worden ingevoerd. deeltjes, en mogelijk koolstofdioxide, kan zeer efficiënt uit de gasstroom worden verwijderd.
Dit kan niet op kleine schaal, zoals aan de achterkant van uw auto hangen. Het wegvervoer stoot momenteel elke dag gevaarlijke hoeveelheden vervuilende stoffen uit in onze steden.
Vergassingsprocessen die ter plaatse waterstofbrandstofcellen gebruiken, kunnen hun efficiëntie aanzienlijk verhogen in vergelijking met traditionele kolengestookte energie. Echter, afhankelijk van het eindgebruik van de waterstof, en daaropvolgende transportprocessen, je bent misschien beter af in termen van energie-output, of efficiëntie (en dus koolstofemissies), gewoon rechtstreeks de kolen verbranden om elektriciteit te maken.
Maar door vergassing van steenkool te gebruiken om waterstof te maken, we kunnen beginnen met het bouwen van de broodnodige infrastructuur en het ontwikkelen van consumentenmarkten (dat wil zeggen, waterstof-brandstofcelvoertuigen) voor een echt schone toekomstige brandstof.
Ik voorspel dat waterstof op een dag emissievrij zal zijn. Het kan op verschillende manieren worden gemaakt door zuiver water te splitsen (inclusief elektrolyse, of door middel van thermochemische en foto-elektrochemische zonnetechnologieën, om er een paar te noemen). Het is er nog niet in termen van prijs of bruikbaarheid, maar het is zeker onderweg. Het stimuleren van de ontwikkeling van de waterstofeconomie door middel van productie uit steenkool in de tussentijd is, in mijn boek, over het algemeen geen slecht idee.
Dit artikel is oorspronkelijk gepubliceerd op The Conversation. Lees het originele artikel. 
 Voor- en nadelen van chemische waterbehandeling
Voor- en nadelen van chemische waterbehandeling  Doorbraak in elektrokatalysatoren gemeld
Doorbraak in elektrokatalysatoren gemeld Onderzoekers stroomlijnen moleculaire assemblagelijn om te ontwerpen, test medicijnverbindingen
Onderzoekers stroomlijnen moleculaire assemblagelijn om te ontwerpen, test medicijnverbindingen Wetenschappers ontdekken verbindingen die hadden kunnen helpen bij het ontstaan van leven op aarde
Wetenschappers ontdekken verbindingen die hadden kunnen helpen bij het ontstaan van leven op aarde Vitamine B7-bewakingsapparaat voor analyse van voedsel en klinische monsters
Vitamine B7-bewakingsapparaat voor analyse van voedsel en klinische monsters
 Twee graden gedecimeerde insectenpopulaties in Puerto Rico
Twee graden gedecimeerde insectenpopulaties in Puerto Rico Zwaveldioxideconcentraties dalen boven India tijdens COVID-19
Zwaveldioxideconcentraties dalen boven India tijdens COVID-19 NASA-animatie volgt de voortgang van Tropical Storm Hannas
NASA-animatie volgt de voortgang van Tropical Storm Hannas Producenten van biomassa kunnen geld binnenhalen terwijl ze switchgrass aanleggen
Producenten van biomassa kunnen geld binnenhalen terwijl ze switchgrass aanleggen De uitstoot van de mensheid 100 keer groter dan die van vulkanen
De uitstoot van de mensheid 100 keer groter dan die van vulkanen
Hoofdlijnen
- De ongelooflijke reis van de eerste Afrikaanse schildpad die in Europa aankwam
- Nieuwe technologie maakt detectie van eikenverwelking sneller, betaalbaarder
- Hoe reproduceren protisten?
- Grootste genetische studie van muggen onthult verspreiding van resistentie tegen insecticiden in Afrika
- Baby bongo geboren, waarschijnlijk binnenkort in Species Survival Center
- Bootverkeer bedreigt het voortbestaan van de Bocas Del Toro-dolfijnen in Panama
- Gemakkelijke manieren om botten te herkennen in anatomie
- Lijst en beschrijf de vier hoofdklassen van moleculen
- Een buitengewoon grotdier gevonden in Oost-Turkmenistan
- Niet alle gelaagde structuren van de natuur zijn zo taai als schelpen en geweien van dieren, studie vondsten

- Team ontwikkelt nieuwe methode om hernieuwbaar acrylonitril te produceren

- Een puzzel strijken

- Onderzoekers bedenken methode om het potentieel van veelgebruikte medicijnen te ontsluiten
- Het meten van ethanol dodelijke tweeling

 5 Componenten van een goed ontworpen wetenschappelijk experiment
5 Componenten van een goed ontworpen wetenschappelijk experiment Machine learning versnelt simulaties in materiaalkunde
Machine learning versnelt simulaties in materiaalkunde Hoe zijn cellulaire ademhaling en fotosynthese bijna tegenovergestelde processen?
Hoe zijn cellulaire ademhaling en fotosynthese bijna tegenovergestelde processen?  Eerdere pandemieën laten zien hoe coronavirusbudgetten kunnen zorgen voor een sneller economisch herstel
Eerdere pandemieën laten zien hoe coronavirusbudgetten kunnen zorgen voor een sneller economisch herstel Achtersteven van Amerikaanse torpedojager uit de Tweede Wereldoorlog ontdekt voor afgelegen eiland in Alaska (update)
Achtersteven van Amerikaanse torpedojager uit de Tweede Wereldoorlog ontdekt voor afgelegen eiland in Alaska (update) Synthetische brandstoffen kunnen de ecologische voetafdruk verkleinen
Synthetische brandstoffen kunnen de ecologische voetafdruk verkleinen Onderzoekers ontdekken dat zwermen kleine organismen voedingsstoffen mengen in oceaanwater
Onderzoekers ontdekken dat zwermen kleine organismen voedingsstoffen mengen in oceaanwater Hoe Yards in Feet
Hoe Yards in Feet
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Danish | Norway | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

