
Wetenschap
De dampdruk van zuiver water is 30 mm van de 10 glucose-oplossing?
De molfractie van water in een 10% glucose-oplossing kan als volgt worden berekend:
Molfractie water =(mol water) / (totaal aantal mol oplossing)
Ervan uitgaande dat we 100 gram oplossing hebben, kunnen we het aantal mol water en glucose als volgt berekenen:
Mol water =(100 - 10) / 18 =5 mol
Mol glucose =10 / 180 =0,0556 mol
Daarom is de molfractie van water:
Molfractie water =5 mol / (5 + 0,0556) mol =0,988
Nu kunnen we de wet van Raoult gebruiken om de dampspanning van de oplossing te berekenen:
Dampspanning van oplossing =Molfractie van water × Dampspanning van zuiver water
Dampspanning van de oplossing =0,988 × 30 mm =29,64 mm
Daarom is de dampspanning van een 10% glucose-oplossing 29,64 mm.
 Wat is de bindingsvolgorde van P2?
Wat is de bindingsvolgorde van P2?  Chemische datamining stimuleert zoektocht naar nieuwe organische halfgeleiders
Chemische datamining stimuleert zoektocht naar nieuwe organische halfgeleiders Hoe beïnvloedt het oplossen van zout in water de massa van water?
Hoe beïnvloedt het oplossen van zout in water de massa van water?  Zeldzame aardelementen in afvalhopen in de mijnbouw
Zeldzame aardelementen in afvalhopen in de mijnbouw Hoe is elektrische aantrekkingskracht belangrijk in zowel ionische als covalente bindingen?
Hoe is elektrische aantrekkingskracht belangrijk in zowel ionische als covalente bindingen?
 Onderzoekers testen het vermogen van drijvende wetlands om de winter te overleven
Onderzoekers testen het vermogen van drijvende wetlands om de winter te overleven Wetenschappers ontdekken hoe gewassen de daglengte gebruiken om te bepalen wanneer ze bloeien
Wetenschappers ontdekken hoe gewassen de daglengte gebruiken om te bepalen wanneer ze bloeien  Nieuw-Zeeland roept symbolisch klimaatnoodtoestand uit
Nieuw-Zeeland roept symbolisch klimaatnoodtoestand uit Een verrassende, trapsgewijze aardbeving
Een verrassende, trapsgewijze aardbeving De gevolgen van droogte op woestijnen
De gevolgen van droogte op woestijnen
Hoofdlijnen
- Waarom 'democratie door afschrikking' in de Verenigde Staten zou kunnen verzwakken
- Flavonoïden van sorghumplanten doden vallegerwormplaag op maïs, kunnen gewas beschermen
- Evolutie ontmoet biochemie om beter te begrijpen hoe dopamine-receptoren werken
- Hoe biologische antropologie werkt
- Mobiele genetische elementen die de functie van nabijgelegen genen veranderen
- Wetenschappers ontdekken waarom sommige eiwitten sneller zijn dan andere
- Hoe babyvissen een thuis vinden
- Onderzoekers ontdekken hoe modelorganisme Tetrahymena roulette speelt met zeven geslachten
- De chemische samenstelling van groene planten
In veel opzichten verschillen planten niet erg van mensen. Als je een plant en een persoon in hun basiselementen zou afbreken, zou je merken dat beide meer koolstof, waterstof en zuurstof bevatten dan w
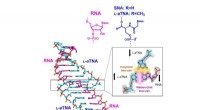
- De helix van het leven:nieuwe studie laat zien hoe RNA zich stabiel bindt aan kunstmatige nucleïnezuren
- ARS Cotton Advance helpt bij het lanceren van wondverband

- Simulaties laten zien hoe bèta-amyloïde neurale cellen kan doden

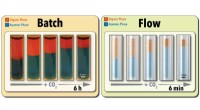
- Groene aanpak versnelt procesoptimalisatie en terugwinning van schakelbare oplosmiddelen
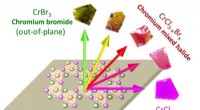
- Gemengde halogenidechemie kan worden gebruikt om magnetisme in ultradunne magnetische apparaten te beheersen
 Welke uitvinding uit de 17e eeuw maakte de ontwikkeling van de moderne celtheorie mogelijk?
Welke uitvinding uit de 17e eeuw maakte de ontwikkeling van de moderne celtheorie mogelijk?  Team ontwikkelt revolutionair omkeerbaar 4D-printen
Team ontwikkelt revolutionair omkeerbaar 4D-printen NASA-satelliet analyseert krachtige supertyfoon Mangkhut
NASA-satelliet analyseert krachtige supertyfoon Mangkhut Netwerken van vitaal belang om leraren door de lockdown heen te helpen
Netwerken van vitaal belang om leraren door de lockdown heen te helpen Wat doodde de jonge walvissen? Nieuw onderzoek vindt een verdachte
Wat doodde de jonge walvissen? Nieuw onderzoek vindt een verdachte  Slow boat naar China:vrachtschepen aangespoord om snelheid en vervuiling te verminderen
Slow boat naar China:vrachtschepen aangespoord om snelheid en vervuiling te verminderen Gevaren van mijnafval benadrukt in VN-rapport
Gevaren van mijnafval benadrukt in VN-rapport De weg verlichten naar selectieve membraanbeeldvorming
De weg verlichten naar selectieve membraanbeeldvorming
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

