
Wetenschap
Wat is evenwichtsdampdruk?
Wanneer een vloeistof of vaste stof zich in een gesloten container bevindt, krijgen sommige moleculen voldoende kinetische energie om van het oppervlak te ontsnappen en in de gasfase terecht te komen. Dit proces wordt verdamping genoemd . Tegelijkertijd verliezen sommige moleculen in de dampfase energie en keren terug naar de vloeibare of vaste fase. Dit proces wordt condensatie genoemd .
Wanneer de verdampingssnelheid gelijk is aan de condensatiesnelheid, wordt gezegd dat het systeem in dynamisch evenwicht verkeert. . Op dit punt is de dampspanning van de stof gelijk aan de evenwichtsdampdruk.
De evenwichtsdampdruk van een stof wordt bepaald door verschillende factoren, waaronder:
* Temperatuur :Naarmate de temperatuur van een stof stijgt, neemt de gemiddelde kinetische energie van zijn moleculen toe. Dit betekent dat meer moleculen voldoende energie hebben om uit de vloeibare of vaste fase te ontsnappen, waardoor de evenwichtsdampdruk toeneemt.
* Intermoleculaire krachten :De sterkte van de intermoleculaire krachten tussen de moleculen van een stof beïnvloedt de evenwichtsdampdruk. Sterkere intermoleculaire krachten houden de moleculen steviger bij elkaar, waardoor het moeilijker wordt om naar de gasfase te ontsnappen. Als gevolg hiervan hebben stoffen met sterkere intermoleculaire krachten een lagere evenwichtsdampspanning.
* Moleculair gewicht :Zwaardere moleculen hebben een lagere evenwichtsdampdruk dan lichtere moleculen. Dit komt omdat zwaardere moleculen meer massa hebben en dus meer energie nodig hebben om naar de gasfase te ontsnappen.
Evenwichtsdampdruk is een belangrijk concept op veel gebieden, waaronder scheikunde, natuurkunde en techniek. Het wordt gebruikt in verschillende toepassingen, zoals:
* Distillatie :Evenwichtsdampdruk wordt gebruikt om vloeistoffen met verschillende kookpunten te scheiden. De vloeistof met de hogere evenwichtsdampdruk zal gemakkelijker verdampen en kan worden opgevangen door condensatie.
* Verdamping :Evenwichtsdampdruk wordt gebruikt om de verdampingssnelheid van een vloeistof te berekenen. Deze informatie is van belang bij uiteenlopende toepassingen, zoals het drogen van materialen en het ontwerpen van verdampers.
* Gaschromatografie :Evenwichtsdampdruk wordt gebruikt om verschillende componenten van een gasmengsel te scheiden en te identificeren. De componenten met de hogere evenwichtsdampdrukken zullen het eerst uit de kolom elueren.
 Klimaatverandering beschadigt het grootste gematigde regenwoud van Noord-Amerika, schade toebrengen aan zalm
Klimaatverandering beschadigt het grootste gematigde regenwoud van Noord-Amerika, schade toebrengen aan zalm Meer licht werpen op hoe duiven navigeren
Meer licht werpen op hoe duiven navigeren  Veranderingen in de controle van het ijsvolume methaanemissies op de zeebodem
Veranderingen in de controle van het ijsvolume methaanemissies op de zeebodem Bosbranden verschroeien huizen van de rijken en beroemdheden in Los Angeles
Bosbranden verschroeien huizen van de rijken en beroemdheden in Los Angeles Wat veroorzaakt algenbloei, en hoe kunnen we ze stoppen?
Wat veroorzaakt algenbloei, en hoe kunnen we ze stoppen?
Hoofdlijnen
- Hoe de nederige zeekomkommer de viskweek zou kunnen transformeren
- Wat zijn banden bij elektroforese?
- Tegelijkertijd inzoomen door tijd en ruimte met superresolutie om te begrijpen hoe cellen zich delen
- 'Als een tunnel voor cholesterol':Wetenschappers laten zien hoe 'slechte' cholesterol in de cellen terechtkomt
- Zijn Chewbacca en Bigfoot gerelateerd?
- Hoe zijn fotosynthese en cellulaire ademhaling gerelateerd
- Law of Segregation (Mendel): definitie, toelichting en voorbeelden
- Hoe Nigeria zijn enorme cashew-afval kan omzetten in waardevol citroenzuur
- Onderzoek toont aan dat planten het gebruik van corrigerende Tipp-Ex-eiwitten beperken
- Onderzoekers ontwikkelen biologisch afbreekbaar geprint display

- Onderzoek toont aan hoe elektriciteitsetende microben elektronen gebruiken om koolstofdioxide te fixeren

- Een efficiëntere manier om hangende olefinen te splitsen van terpenen en soortgelijke verbindingen
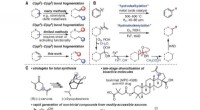
- Gekweekte stamcellen reconstrueren sensorische zenuw- en weefselstructuur in de neus
- Stam gebruiken om oxynitride-eigenschappen te beheersen

 Plant een boom:Milans ambitieuze plannen om schoner te worden, groener
Plant een boom:Milans ambitieuze plannen om schoner te worden, groener Hoe je een veerkrachtig merk bouwt
Hoe je een veerkrachtig merk bouwt  Vrijstaande anode voor gebruik bij het helpen van microbiële brandstofcellen om afval om te zetten in elektriciteit
Vrijstaande anode voor gebruik bij het helpen van microbiële brandstofcellen om afval om te zetten in elektriciteit Fietssucces kan de sleutel zijn om vijfde van landbouwgrond vrij te maken
Fietssucces kan de sleutel zijn om vijfde van landbouwgrond vrij te maken Veilige en effectieve brandbestrijding aan boord
Veilige en effectieve brandbestrijding aan boord Hoe het hebben van zelfbeheersing tot macht leidt
Hoe het hebben van zelfbeheersing tot macht leidt  Waterkrachtdammen kunnen kustgebieden ver benedenstrooms schaden
Waterkrachtdammen kunnen kustgebieden ver benedenstrooms schaden Wetenschappers zetten stappen richting volledig hernieuwbare energie
Wetenschappers zetten stappen richting volledig hernieuwbare energie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

