
Wetenschap
Waarom zijn het smelt- en kookpunt van alkalimetalen lager in vergelijking met aardalkalimetalen?
1. Grotere atomaire omvang: Alkalimetalen hebben grotere atoomgroottes vergeleken met aardalkalimetalen. Dit komt omdat naarmate we een groep lager in het periodiek systeem komen, de atomaire grootte doorgaans toeneemt. Deze toename in atomaire grootte leidt tot zwakkere metaalbindingen in alkalimetalen. Hoe groter de atomaire grootte, hoe zwakker de metaalbindingen en hoe lager de smelt- en kookpunten.
2. Zwakkere metaalbinding: Alkalimetalen hebben één valentie-elektron in hun buitenste schil, terwijl aardalkalimetalen twee valentie-elektronen hebben. De aanwezigheid van een extra valentie-elektron in aardalkalimetalen resulteert in een sterkere metaalbinding. Sterkere metaalverbindingen vereisen meer energie om te breken, wat leidt tot hogere smelt- en kookpunten.
3. Lagere ionisatie-energie: Alkalimetalen hebben lagere ionisatie-energieën vergeleken met aardalkalimetalen. Ionisatie-energie verwijst naar de energie die nodig is om een elektron uit een atoom te verwijderen. Hoe lager de ionisatie-energie, hoe gemakkelijker een elektron kan worden verwijderd. Dit betekent dat alkalimetalen gemakkelijker hun valentie-elektronen verliezen, wat resulteert in zwakkere metaalbindingen en lagere smelt- en kookpunten.
4. Kleinere roosterenergie: Roosterenergie is de energie die nodig is om ionen in een kristalrooster te scheiden. Alkalimetalen hebben kleinere roosterenergieën vergeleken met aardalkalimetalen. Dit komt omdat hoe groter de grootte van de ionen is, hoe zwakker de elektrostatische aantrekkingskracht tussen hen is. De kleinere roosterenergie in alkalimetalen maakt het gemakkelijker voor de ionen om de aantrekkingskrachten te overwinnen en uit het rooster te ontsnappen, wat resulteert in lagere smelt- en kookpunten.
Samenvattend leidt de combinatie van grotere atomaire afmetingen, zwakkere metaalbinding, lagere ionisatie-energie en kleinere roosterenergie in alkalimetalen tot lagere smelt- en kookpunten in vergelijking met aardalkalimetalen.
 Wat is een ijsvulkaan?
Wat is een ijsvulkaan?  Veranderingen in de landbouw dringend om de biodiversiteit te redden, wetenschappers zeggen:
Veranderingen in de landbouw dringend om de biodiversiteit te redden, wetenschappers zeggen: Oude landbouwactiviteiten veroorzaakten blijvende veranderingen in het milieu
Oude landbouwactiviteiten veroorzaakten blijvende veranderingen in het milieu Broeikasgassen veroorzaken meer veranderingen dan we aankunnen
Broeikasgassen veroorzaken meer veranderingen dan we aankunnen Dallas is slechts de nieuwste overstromingsramp:hoe steden kunnen leren van de huidige klimaatcrises om zich voor te bereiden op morgen
Dallas is slechts de nieuwste overstromingsramp:hoe steden kunnen leren van de huidige klimaatcrises om zich voor te bereiden op morgen
Hoofdlijnen
- Waar gaat AlphaGo heen?
- Wat zijn protosme's?
- Herinneren we ons slechte tijden beter dan goede?
- Nieuwe hoop voor ernstig bedreigde aap met stompe neus in Myanmar
- Onderzoek naar 's werelds grootste boomgroep zal helpen bij het behoud en beheer van regenwouden
- De cel die door een virus is geïnfecteerd, wordt de?
- Wat is geluk?
- Is er een gen voor elke ziekte?
- Welke waarden zijn belangrijk voor wetenschappers?
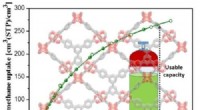
- Aardgas kan de kloof overbruggen van benzine naar elektrische voertuigen, dankzij metaal-organische raamwerken
- Biosensor maakt realtime zuurstofmonitoring mogelijk voor organen-op-een-chip

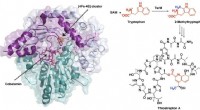
- Synthese van krachtig antibioticum volgt ongebruikelijke chemische route
- Nieuw type plastic gemaakt van teruggewonnen afval

- Door polyurethaan afbreekbaar te maken, krijgen de componenten een tweede leven

 Hoe krijgen vloeistoffen de vorm van de container waarin ze worden gegoten?
Hoe krijgen vloeistoffen de vorm van de container waarin ze worden gegoten?  ELFIN om te bestuderen hoe elektronen verloren gaan
ELFIN om te bestuderen hoe elektronen verloren gaan  DreamBox Learning krijgt $ 130 miljoen voor software voor wiskundeonderwijs
DreamBox Learning krijgt $ 130 miljoen voor software voor wiskundeonderwijs Waarom is PVC zacht en flexibel, terwijl bakeliet hard bros is?
Waarom is PVC zacht en flexibel, terwijl bakeliet hard bros is?  Onderzoekers laten zien hoe grafeen-metaal-interfaces elektronen beïnvloeden
Onderzoekers laten zien hoe grafeen-metaal-interfaces elektronen beïnvloeden Uit onderzoek blijkt wat kiezers naar de stembus drijft
Uit onderzoek blijkt wat kiezers naar de stembus drijft  Moleculair fossiel:De kristalstructuur laat zien hoe RNA, een van de oudste katalysatoren in de biologie, wordt gemaakt
Moleculair fossiel:De kristalstructuur laat zien hoe RNA, een van de oudste katalysatoren in de biologie, wordt gemaakt  Hoe ver kan het menselijk oog kijken?
Hoe ver kan het menselijk oog kijken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

